[Jak wielkim zagrożeniem środowiskowym jest produkcja plastiku nie trzeba dziś nikomu wyjaśniać. Z tego powodu z wielkim zainteresowaniem sięgamy po artykuły o chwytliwych tytułach „Bakterie w walce z plastikiem”, „Zmutowane bakterie jedzą plastik. Naukowcy: i to w kilka godzin”, czy nawet w dość poważnym piśmie jak National Geographic: „Nauczyli bakterie jeść plastik. Butelki PET znikają w godziny” itp. Dowiadujemy się z nich np. że: Biologiczny recykling butelek z plastiku typu PET (z politereftalanu etylenu, jednego z najczęściej wykorzystywanych tworzyw – red.) na masową skalę staje się rzeczywistością lub, że: Japoński zespół na łamach „Scientific Reports” opisał tymczasem bakterię, która może pomóc w rozwiązaniu poważnego kłopotu na dwa sposoby. Po pierwsze, jest ona zdolna do rozkładania PET używanego do wyrobu butelek, ubrań, opakowań i całej masy innych produktów. Jednocześnie wytwarza substancję, którą można wykorzystać w charakterze tworzywa bezpiecznego dla środowiska. (21 paź 2021 ) oraz: Wstępne badania opublikowane w magazynie Science potwierdzają, że wyjątkowe bakterie o nazwie ideonella sakaiensis mogą być ostatnią deską ratunku dla Ziemi zasypanej plastikowymi śmieciami. Te naturalnie rozkładają się nawet setki lat.
Czy rzeczywiście możemy w przyszłość spoglądać z optymizmem? Nasza redakcja postanowiła przyjrzeć się temu zagadnieniu nieco głębiej. Już dość pobieżna kwerenda w Internecie naprowadziła nas na artykuł publikujący badania w tym zakresie prowadzone przez zespół naukowców w Nowej Zelandii.
W tekście tym nie znajdziemy żadnych sensacji, zajmie nam on zapewne więcej niż kilka minut (codzienne portale coraz częściej zamieszczają informacje dla swych potencjalnych czytelników: tekst ten przeczytasz w 2 minuty, 3 minut itp.), sądzimy jednak, że dzisiejszemu tematowi warto poświęcić nieco więcej czasu i uwagi. Zagadnienia w nim poruszane są zbyt ważne, by informacje o nich traktować tylko jako jeszcze jedną z rozrywek, ciekawostek, o których można opowiedzieć znajomym.
Redakcja]
Tworzywa sztuczne i mikrobiom: skutki i rozwiązania
Abstrakt
Globalna produkcja tworzyw sztucznych, w tym rodzajów polimerów z różnymi dodatkami i wypełniaczami, wzrasta wykładniczo od czasu rozpoczęcia produkcji w latach pięćdziesiątych XX wieku. Podczas gdy negatywne skutki tworzyw sztucznych są znane dość szeroko, szczególnie w przypadku kręgowców morskich, wpływ na życie mikrobiologiczne pozostaje rozpoznany stosunkowo słabo. Tworzywa sztuczne wpływają bezpośrednio na mikrobiomy, wywierając działanie toksyczne, zapewniając dodatkowe źródła węgla i działając jako rodzaj pośredników w procesie kolonizacji i rozprzestrzeniania się drobnoustrojów. Pośrednie konsekwencje ich działań obejmują zwiększone zacienienie środowiska, zmieniony skład społeczności żywicieli i zakłócenie organizmu gospodarza lub zdrowia społeczności, równowagi hormonalnej i odpowiedzi immunologicznej. Izolacja i zastosowanie drobnoustrojów degradujących tworzywa sztuczne są zagadnieniem bardzo interesującym, ale niewiele dowodów potwierdza biodegradację mikrobiologiczną większości syntetycznych polimerów o dużej masie cząsteczkowej. Przypuszczalnie zidentyfikowano ponad 400 gatunków drobnoustrojów zdolnych do degradacji tworzyw sztucznych, ale dowody na degradację bardzo rozpowszechnionych polimerów, w tym polipropylenu, nylonu, polistyrenu i polichlorku winylu, należy traktować z ostrożnością; w większości badań nie uwzględnia się strat spowodowanych wypłukiwaniem lub degradacją monomerów polimerowych, dodatków lub wypełniaczy. Nawet tam, gdzie wykazano degradację polimeru, tak jak w przypadku politereftalanu etylenu, zdolność mikroorganizmów do degradacji bardziej krystalicznych postaci polimeru stosowanego w komercyjnych tworzywach sztucznych wydaje się ograniczona. Mikrobiomy często działają w połączeniu z czynnikami abiotycznymi, takimi jak ciepło i światło, wpływając na integralność strukturalną polimerów i dostępność do ataku enzymatycznego. W związku z tym pozostaje wiele możliwości zbadania mikrobiomów ekstremofilnych jako źródła enzymów i mikroorganizmów rozkładających tworzywa sztuczne. Proponujemy przegląd pracy opartych na najlepszych praktykach w zakresie izolowania i zgłaszania taksonów degradujących tworzywa sztuczne z różnych mikrobiomów środowiskowych, który powinien obejmować wiele linii dowodów potwierdzających zmiany w strukturze polimeru, utratę masy i wykrywanie przypuszczalnych produktów degradacji, wraz z potwierdzeniem szczepów drobnoustrojów i enzymów (i związanych z nimi genów) odpowiedzialnych za degradację polimerów o dużej masie cząsteczkowej. Takie podejście jest niezbędne do odróżnienia enzymatycznych degradatorów polimerów tworzyw sztucznych o dużej masie cząsteczkowej od organizmów zdolnych jedynie do degradacji bardziej labilnego węgla w głównie amorficznych tworzywach sztucznych, monomerach tworzyw sztucznych, dodatkach lub wypełniaczach.
Globalne zanieczyszczenie plastikiem
Pierwszy plastik produkowany w ilościach komercyjnych, bakelit, został wynaleziony na początku XX wieku. Niedobór zasobów i potrzeba ulepszenia technologii po pierwszej wojnie światowej doprowadziły do opracowania nowych i ulepszonych materiałów syntetycznych, w tym tworzyw sztucznych. Tworzywa sztuczne stanowią obecnie dużą i zróżnicowaną grupę materiałów wykonanych z kombinacji syntetycznych i półsyntetycznych materiałów polimerowych, często zawierających dodatki wspomagające wytwarzanie i właściwości produktu końcowego, takie jak plastyfikatory, przeciwutleniacze i środki zmniejszające palność [ 1]. Tworzywa sztuczne pochodzą głównie z paliw kopalnych (np. ropy naftowej lub gazu ziemnego), chociaż mogą być również wytwarzane z zasobów odnawialnych (np. tworzywa sztuczne pochodzenia biologicznego pochodzące ze skrobi kukurydzianej lub buraków cukrowych); tworzywa sztuczne, takie jak politereftalan etylenu (PET), mogą być syntetyzowane z dowolnego źródła i są czasami określane jako tworzywa sztuczne „drop-in”. Wraz z nadejściem masowego konsumpcjonizmu w latach 60. i odejściem od tradycyjnych materiałów naturalnych na rzecz bardziej uniwersalnych tworzyw sztucznych, tworzywa sztuczne są obecnie integralną częścią naszego codziennego życia. Produkcja tworzyw sztucznych wzrasta wykładniczo od lat 50. XX wieku, przy czym szacuje się, że dotychczas wyprodukowano 8300 milionów ton metrycznych pierwotnego plastiku, a oczekiwana roczna stopa produkcji wyniesie 1100 ton do 2050 r. [ 2 ].
Pomimo dużej różnorodności dostępnych polimerów, zaledwie osiem stanowi 95% wszystkich pierwotnych tworzyw sztucznych, jakie kiedykolwiek wyprodukowano, przy czym polipropylen i polietylen stanowią 45% światowej produkcji [ 2 ]. Głównym zastosowaniem tworzyw sztucznych są opakowania (36%), a następnie zastosowanie w budownictwie (16%) [ 3]. Obecnie dominujące typy polimerów są w całości oparte na paliwach kopalnych i nie ulegają biodegradacji w skali czasowej odpowiedniej dla zarządzania wycofaniem z eksploatacji. Biodegradowalne polimery na bazie paliw kopalnych, takie jak polikaprolakton (PCL) i politereftalan adypinianu butylenu (PBAT), nie są obecnie stosowane na dużą skalę. W rzeczywistości mniej niż 1% polimerów jest pochodzenia biologicznego, z czego 44,5% to polimery „drop-in”, które mają te same właściwości, co ich wersje oparte na paliwach kopalnych, tj. uważa się, że nie ulegają rozkładowi [ 4 ]. Z prawie 360 milionów ton plastiku produkowanego rocznie tylko niewielka część (~ 1%) jest pochodzenia biologicznego [ 4 ].
Pod koniec życia tworzywa sztuczne mają zasadniczo trzy losy: recykling; spalanie i usuwanie. Do tej pory zarządzanie wycofanymi z eksploatacji produktami z tworzyw sztucznych nie nadążało za szybkim wzrostem produkcji, co skutkowało powszechnym skażeniem środowiska. Szacuje się, że na całym świecie tylko 10% tworzyw sztucznych poddaje się recyklingowi, a 14% spalaniu; pozostałe 76% trafia na składowiska lub trafia do środowiska naturalnego [ 2 ]. Niedawne modelowanie szacuje, że przy obecnych wskaźnikach strat, bez zmian w praktykach gospodarowania i w połączeniu z przewidywanym wzrostem produkcji, do 2040 r. do środowiska trafi łącznie 710 mln ton odpadów z tworzyw sztucznych [ 5 ]. Podczas gdy zwykle przy omawianiu wycieku do środowiska przychodzą na myśl duże odpady z tworzyw sztucznych, naturalne zużycie przedmiotów, takich jak liny, odzież i opony, powoduje wydzielanie się małych fragmentów podczas użytkowania, ułatwiając bierny transport mniejszych fragmentów plastiku do środowiska. Te fragmenty, gdy są mniejsze niż 5 mm, nazywane są mikroplastikami lub nanoplastikami, jeśli są mniejsze niż 1 μm [ 6 ]. Oczekuje się, że wyciek mikroplastiku wzrośnie o 1,3 – 2,5 razy do 2040 r. w scenariuszu „business-as-usual” i odpowiada około 3 milionom bilionów sztuk [ 5 ]. To powszechne przenikanie tworzyw sztucznych do środowiska oznacza, że są one rozprowadzane na całym świecie w wielu różnych formach i we wszystkich dotychczas zbadanych ekosystemach; z rzek i strumieni [ 7 ,8 ] do głębokich rowów oceanicznych [ 9 , 10 ], szczytów górskich [ 11 ] oraz od tropików [ 12 ] po bieguny [ 13 ].
Mikrobiologiczne skutki globalnego zanieczyszczenia tworzywami sztucznymi
Niedawna śmierć wieloryba dziobowatego Cuvier na Filipinach z 40 kg plastikowych odpadów w żołądku [ 14 ] oraz sekcja zwłok młodego kaszalota na szkockiej plaży, podczas której znaleziono 100 kg śmieci [ 15 ] przykuły uwagę światowych mediów, a naukowcy kontynuują raportowanie wpływu odpadów z tworzyw sztucznych na wiele gatunków [ 16 , 17 , 18 ]. Wykazano już, że ponad 800 gatunków zwierząt zostało dotkniętych zanieczyszczeniem tworzywami sztucznymi, a wraz ze wzrostem ich liczby, od detrytycznych ślimaków morskich [ 19 ] po szczytowe drapieżniki morskie [ 20 , 21 ], które mają zinternalizowane tworzywa sztuczne. Na całym świecie Wilcox i in. [ 22 ] przewidują, że aż 90% wszystkich ptaków morskich spożywa tworzywa sztuczne. Zdjęcia pośmiertne tworzyw sztucznych wyciekających z wnętrzności poddanych sekcji zwierząt morskich skłaniają nas do ponownego rozważenia niezrównoważonego wykorzystania plastiku, jednak wpływ zanieczyszczenia tworzywami sztucznymi na większość mniejszych organizmów pozostaje mniej zbadany. Z pewnością odnotowano negatywne skutki stosowania tworzyw sztucznych dla meiofauny, takiej jak nicienie Daphnia magna [ 23 ] i Caenorhabditis elegans [ 24 ], w dużej mierze przypisywane wpływom toksykologicznym lub zablokowaniu układu pokarmowego i związanemu z tym zmniejszeniu tempa karmienia. Natomiast wpływ tworzyw sztucznych na środowiskowe zbiorowiska mikroorganizmów jest raczej słabo zbadany.
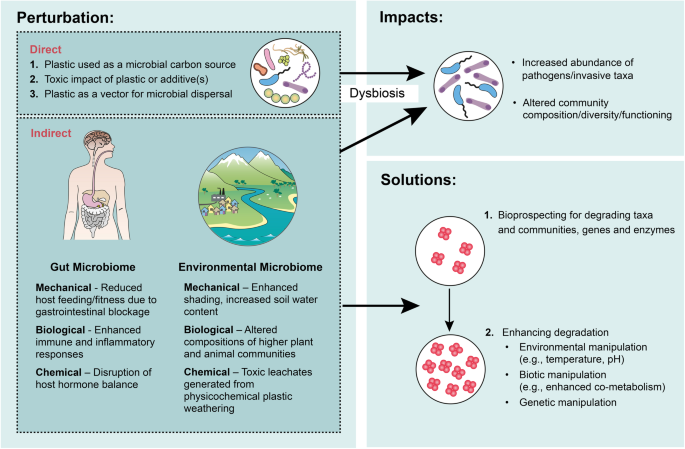
Termin „mikrobiom” opisuje połączony materiał genetyczny lub społeczność mikroorganizmów zamieszkujących określone środowisko. Podczas gdy naukowcy nadal badają różnorodne mikrobiomy, w tym środowiska glebowe, morskie, słodkowodne, atmosferyczne i podpowierzchniowe, termin „mikrobiom” jest prawdopodobnie używany głównie do opisania badań mikrobiomu przewodu pokarmowego (tzw. „mikrobiomu jelitowego”). Ponieważ środowiskowe tworzywa sztuczne mogą gromadzić się w przewodach pokarmowych organizmów z różnych poziomów troficznych [ 25 , 26 , 27] mają potencjał wpływania na mikrobiom jelitowy. Jednak ze względu na ich powszechną dystrybucję w środowisku, skutki zanieczyszczenia tworzywami sztucznymi rozciągają się dalej na mikrobiomy różnych środowisk niezwiązanych z żywicielem (które dalej nazywamy „mikrobiomem środowiskowym”). Bezpośredni wpływ tworzyw sztucznych na mikrobiom jelitowy i środowiskowy jest wieloraki (ryc. 1 ). (i) Niektóre tworzywa sztuczne i/lub związane z nimi dodatki dostarczają źródeł węgla organicznego metabolizowanego przez określone mikroorganizmy. Jednak degradacja mikrobiologiczna większości tworzyw sztucznych jest ograniczona tylko do kilku taksonów [ 28 ] pozostaje powolny, a w wielu przypadkach jest niesprawdzony lub kwestionowany. Rzeczywiście, pozostaje niewiele dowodów na degradację mikrobiologiczną dominujących polimerów tworzyw sztucznych, w tym polipropylenu, polistyrenu, polietylenu, nylonu i polichlorku winylu [ 29 ]. Z tych powodów wpływ tworzyw sztucznych na społeczności drobnoustrojów jako źródła dodatkowego węgla będzie prawdopodobnie minimalny, szczególnie w środowiskach naturalnych, w których dominują alternatywne nietrwałe źródła węgla i energii. Godnym uwagi wyjątkiem może być konsumpcja plastiku przez niektóre owady, w przypadku których postuluje się, że degradacja mikrobiologiczna jest wzmocniona poprzez „uprzednią obróbkę” przez enzymy obecne w jelicie [ 30 ]; hipoteza ta pozostaje jednak niepotwierdzona. (ii) W dużym stopniu czyste polimery z tworzyw sztucznych są chemicznie łagodne i mają niewielki wpływ toksyczny. Jednak przemysłowe tworzywa sztuczne zawierają dodatki, w tym środki zmniejszające palność (np. polichlorowane bifenyle i polichlorowane naftaleny), plastyfikatory (np. bisfenol A) i stabilizatory UV (np. benzotriazole), z których część ma wpływ na skład i funkcjonowanie społeczności drobnoustrojów. Na przykład odcieki tworzyw sztucznych z polietylenu o dużej gęstości (HDPE) i polichlorku winylu (PVC) wywierają toksyczny wpływ na Prochlorococcus spp., upośledzając wzrost komórek i gęstość populacji w sposób zależny od dawki [ 31]. Prochlorokoki jest jednym z najliczniejszych organizmów fotosyntetyzujących na Ziemi [ 32 ], odpowiedzialnym za około 10% pierwotnej produkcji netto oceanów [ 33 ]; w tym względzie wykazano, że zanieczyszczenie tworzywami sztucznymi może wpływać na główne globalne procesy mikrobiologiczne. Spożywanie plastyfikatorów, w tym bisfenolu A [ 34 ], może podobnie powodować dysbiozę mikrobiomu jelitowego, wpływając na zdrowie gospodarza. (iii) Tworzywa sztuczne mogą również zmieniać społeczności drobnoustrojów, wpływając na tempo i zakres rozprzestrzeniania się, ponieważ zapewniają powierzchnię przyczepiania się drobnoustrojówi tym samym może wspomagać transport komórek drobnoustrojów, w tym patogenów, zarówno na całym świecie, jak i do jelit. W porównaniu z tymi bezpośrednimi wpływami tworzyw sztucznych na mikrobiomy, znacznie mniej wiadomo o ich pośrednim wpływie. Tworzywa sztuczne i ich dodatki mogą wpływać na zdrowie organizmów żywicielskich, co ma konsekwencje dla mikroflory jelitowej, która jest nieodłącznym elementem dobrostanu zwierząt wyższych [ 35 ].
W tym przeglądzie zwracamy uwagę na najnowszą wiedzę na temat bezpośredniego i pośredniego wpływu tworzyw sztucznych na zdrowie i funkcjonowanie mikrobiomów środowiskowych, w tym jelit. Ponadto rozważamy, w jaki sposób można złagodzić wpływ tworzyw sztucznych, a także manipulować nimi, aby zwiększyć zarówno tempo, jak i zakres degradacji tworzyw sztucznych.
Wpływ tworzyw sztucznych na mikrobiom jelitowy
Tworzywa sztuczne powodują szereg niepożądanych mechanicznych, chemicznych i biologicznych skutków dla gatunków, które je spożywają. Spożywanie tworzyw sztucznych, bezpośrednio lub poprzez transfer troficzny [ 25 ], ma wiele bezpośrednich konsekwencji, zmniejszając apetyt, wpływając na aktywność żywieniową i zmniejszając masę ciała [ 36 ], sprawność fizyczną [ 37 ] i płodność [ 38 ]. W ciężkich przypadkach nagromadzenie dużych plastycznych mas może zablokować przewód pokarmowy; zostało to odnotowane jako przyczyna śmierci różnych gatunków, w tym waleni [ 39 , 40 ], żółwi [ 41 ] i ptaków [ 42]. Mniejsze frakcje plastiku mogą również ulegać bioakumulacji w organizmie, głównie w jelicie, chociaż donoszono o translokacji tworzyw sztucznych przez hemolimfę i hemocyty filtratorów [ 26 , 43 ], w tym do narządów takich jak wątroba i nerki [ 44 , 45 ] . ; implikuje to zdolność mikrodrobin plastiku do przenikania przez wyściółkę nabłonka jelita po spożyciu i dostania się do układu krążenia. Avio i in. [ 43 ] zbadali wpływ mikroplastików polietylenu i polistyrenu na małże śródziemnomorskie ( Mytilus galloprovincialis). Po 7 dniach ekspozycji na tworzywo sztuczne, analiza histologiczna wykazała skupienia tworzywa sztucznego w świetle jelita, nabłonku i kanalikach. Co więcej, zwiększone pękanie nici DNA dostarcza dowodów na wpływ genotoksyczny, prawdopodobnie spowodowany większą produkcją reaktywnych form tlenu (ROS) w odpowiedzi na mikroplastiki. Szlaki sygnałowe receptora podobne do domeny oligomeryzacji wiążącej nukleotydy lub podobne do receptora NOD zostały wzbogacone w M. galloprovincialis wystawionym na działanie mikroplastików; receptory te rozpoznają czynniki chorobotwórcze przedostające się do komórki poprzez fagocytozę i aktywują reakcje zapalne. Odkrycia te potwierdzają rosnącą liczbę dowodów na to, że mikro- i nanoplastiki przekraczają bariery biologiczne, promując reakcje immunologiczne i zapalne [ 45 , 46]. Tam, gdzie mikroplastiki wpływają na odporność gospodarza, może to dodatkowo powodować zmiany w składzie i funkcjonowaniu społeczności drobnoustrojów jelitowych. Stany oksydacyjne spowodowane stanem zapalnym mogą sprzyjać dominacji bardziej opornych grup bakteryjnych, a jeśli są związane ze wzrostem beztlenowych akceptorów końcowych elektronów w układzie oddechowym, mogą sprzyjać wzrostowi taksonów beztlenowych, takich jak przedstawiciele Enterobacteriaceae [ 47 ]. Mikrobiom jelitowy wpływa nie tylko na układ odpornościowy gospodarza, ale także przyczynia się do trawienia i dostarczania niezbędnych składników odżywczych [ 48 ], degradacji szkodliwych substancji [ 49 ] i zwalczania patogenów w jelitach [ 50 ]. Konsumpcja i translokacja mikroplastiku między tkankami ciała ma zatem daleko idące konsekwencje dla homeostazy normalnie utrzymywanej między gospodarzem a jego mikrobiomem.
Podczas gdy fizyczna obecność tworzyw sztucznych wyraźnie wpływa na oś mikrobiom-jelito-odporność, dodatki, które są wypłukiwane z polimerów tworzyw sztucznych, mają dalsze konsekwencje. Plastyfikatory to największa grupa dodatków do tworzyw sztucznych [ 51 ], w szczególności ftalany, które mogą gromadzić się w tkankach organizmu i wywoływać liczne działania niepożądane. Na przykład ftalan dietyloheksylu (DEHP) ma właściwości antyestrogenowe u ryb, utrudniając rozwój narządów rozrodczych [ 52 ], prawdopodobnie z powodu konkurencji z endogennymi estrogenami o receptor, a ftalany dibutylu opóźniają rozwój i funkcjonowanie gonad u ssaków [ 53 ] i płazy [ 54]. Obecność bisfenolu A (BPA) w środowisku wynika przede wszystkim z tego, że jest on konstytutywnym monomerem poliwęglanowych tworzyw sztucznych, chociaż jest również powszechnie dodawany do PCW jako plastyfikator. BPA ma feminizujący wpływ na ryby, zmniejszając jakość nasienia samców, opóźniając i hamując owulację u samic [ 55 ], aw przypadku narażenia na wysokie stężenie może wywoływać stany interseksualne [ 56 ]. Zgłasza się wpływ na wiele innych organizmów; BPA wpływa na funkcjonowanie tarczycy i rozwój larw u płazów [ 57 ], wczesny rozwój zarodków u małży morskich [ 58 ] oraz masę urodzeniową reprodukcyjną i zmienioną cykliczność rujową u ssaków [ 59 , 60]. Tworzywa sztuczne pochłaniają również zanieczyszczenia organiczne, takie jak polichlorowany bifenyl (PCB) z otoczenia [ 61 , 62 ]; te zanieczyszczenia mogą być przenoszone do tkanek biologicznych organizmów, takich jak ptaki, po spożyciu plastiku [ 51 ]. Chociaż jest mało prawdopodobne, aby stężenia zanieczyszczeń związanych z tworzywami sztucznymi były głównym czynnikiem przyczyniającym się do środowiskowych stężeń zanieczyszczeń, takich jak PCB [ 63 ], przy ocenie wpływu zanieczyszczenia tworzywami sztucznymi na interakcje żywiciel-mikrobiom należy wziąć pod uwagę różne związki związane z tworzywami sztucznymi [ 64 ].
Wpływ dodatków z tworzyw sztucznych na mikrobiom jelitowy pozostaje mało zbadany, chociaż Adamovsky i in. [ 65 ] ocenili wpływ istotnych dla środowiska stężeń szeroko stosowanego plastyfikatora DEHP [ 66 ] na danio pręgowanego. DEHP powodował dysbiozę mikroflory jelitowej [ 67], a ocena transkryptomu żołądkowo-jelitowego ujawniła regulację w górę limfocytów T, które, jak się uważa, odgrywają kluczową rolę w neutralizacji patogenów poprzez utrzymanie integralności nabłonka jelitowego, przy jednoczesnym obniżeniu poziomu neuropeptydu Y, hormonu, który może modyfikować aktywność immunologiczną poprzez regulację funkcji limfocytów T. Analiza mikrobiomu jelitowego wykazała udział kilku metabolitów drobnoustrojów, które mogą przyczyniać się do komunikacji immunologicznej i międzykomórkowej, w tym zmniejszonej ilości L-glutaminy u mężczyzn i D-fruktozo-6-fosforanu u kobiet. Po ekspozycji na DEHP Adamovsky i in. [ 65 ] zidentyfikowali w ten sposób wpływ mikrobiologicznych bioaktywnych metabolitów na dysregulację układu odpornościowego gospodarza. Zgłaszane są dalsze negatywne skutki. Na przykład obfitość Mogibacteriaceae, Sutterellaspp, a liczba bakterii Clostridiales jest zwiększona u samic myszy narażonych na BPA [ 68 ], prawdopodobnie z powodu zakłócenia regulacji hormonów płciowych testosteronu i estrogenu, co sugeruje, że BPA powoduje zależne od płci zmiany w mikrobiomie jelitowym. W wielu badaniach potwierdzono, że ekspozycja zwierząt na plastyfikatory i prekursory tworzyw sztucznych, w tym BPA, wpływa na profile drobnoustrojów jelitowych [ 69 , 70 , 71 ], czasami faworyzując mikrobiologiczne markery dysbiozy, takie jak dominacja proteobakterii w społeczności [ 72 ]. Niemniej jednak zrozumienie przyczyn i skutków w interakcjach między gospodarzem a mikrobiomem pozostaje ograniczone.
Jak później opiszemy, mikrodrobiny plastiku są potencjalnymi wektorami szkodników i patogenów na całym świecie za pośrednictwem prądów oceanicznych, ale mogą również przenosić patogeny do jelit. Przyczepność mikroorganizmów do cząstek plastiku może zwiększyć zarówno rozprzestrzenianie się drobnoustrojów, jak i przeżycie, ponieważ biofilmy zapewniają ochronę przed stresem środowiskowym i zwiększone możliwości dzielenia się korzystnymi cechami poprzez poziomy transfer genów. Patogeny, takie jak Vibrio parahaemolyticus, powodujące posocznicę i zapalenie żołądka i jelit u ludzi, zostały zidentyfikowane w morskich zbiorowiskach biofilmu związanych z tworzywami sztucznymi [ 73] i połknięcie takich organizmów autostopem na tworzywach sztucznych może wywołać chorobę. Jednak nawet jeśli nie są chorobotwórcze, połknięte organizmy mogą wpływać na skład społeczności jelitowej, jeśli są zdolne do konkurowania o zasoby w jelitach [ 74 ]. Chociaż ostatnio odkryto bogatą taksonomiczną i funkcjonalną różnorodność zbiorowisk drobnoustrojów „plastysfery” [ 75 ], rola tworzyw sztucznych w rozprzestrzenianiu się drobnoustrojów i kolonizacji jelit pozostaje słabo zbadana i poznana.
Wpływ tworzyw sztucznych na mikrobiom środowiskowy
W środowiskach lądowych sama obecność tworzyw sztucznych wywiera fizyczny wpływ na społeczności drobnoustrojów. Na przykład rolnicza folia ściółkowa z tworzywa sztucznego zastosowana w celu zwiększenia krótkoterminowej produktywności upraw obejmuje około 20 milionów hektarów gruntów rolnych na całym świecie [ 76 ] i jest znaczącym źródłem zanieczyszczenia lądowego tworzywami sztucznymi [ 77 ]. Podczas gdy większość badań koncentrowała się na wpływie syntetycznych folii z tworzyw sztucznych, stwierdzono, że mikrobiologiczna konsumpcja biodegradowalnych tworzyw sztucznych ma głęboki wpływ na społeczności drobnoustrojów glebowych [ 78 ]. Po osadzeniu w glebie tworzywa sztuczne wpływają na interakcje gleba-woda poprzez zwiększenie zawartości wody [ 79 ], która jest głównym wyznacznikiem składu i funkcjonowania społeczności drobnoustrojów glebowych [ 80, 81 ]. Zmieniając dostępność wody, fizyczny wpływ tworzyw sztucznych na mikrobiom środowiskowy gleby może być znaczny [ 82 ]; konsekwencje innych oddziaływań fizycznych, takie jak zwiększone zacienienie przez tworzywa sztuczne, które, jak przypuszczano, zmniejszają fotosyntezę w wodzie, pozostają w dużej mierze niezbadane [ 83 , 84 ].
Obecność plastiku ma bezpośrednie konsekwencje chemiczne dla środowiskowych społeczności drobnoustrojów. Łatwo biodegradowalne tworzywa sztuczne, takie jak kwas polimlekowy (PLA), dostarczają dostępnego węgla, a w niektórych przypadkach znacznie zwiększają biomasę drobnoustrojów i aktywność enzymów [ 85 ]. Obecność takich tworzyw sztucznych w glebie zmienia skład zbiorowisk, wzbogacając liczebność i aktywność niektórych taksonów (np. przedstawicieli grzybów Ascomycota [ 86 ]). Wpływ bardziej opornych tworzyw sztucznych pozostaje mniej zrozumiały, chociaż nawet tam, gdzie degradacja jest powolna, plastyfikatory i dodatki, takie jak estry kwasów ftalanowych, mogą mimo wszystko wypłukiwać, osiągając podwyższone stężenia w środowiskach przyjmujących [ 87 ] i powodują znaczące zmiany w składzie społeczności drobnoustrojów, obfitości i aktywności enzymów [ 88 , 89 ]. Chociaż nie zawsze obserwuje się wpływ dodatków do tworzyw sztucznych na mikrobiomy środowiskowe w stężeniach istotnych dla środowiska [ 90 ], sama różnorodność stosowanych dodatków do tworzyw sztucznych [ 91 ] oznacza, że ich wpływ nie został jeszcze w pełni poznany. Szczególnie interesujący jest Tetu i in. [ 31 ] zbadali wpływ odcieku plastiku z worków HDPE i mat PVC na morskie Prochlorococcus i potwierdzili, że narażenie na nawet najmniejsze rozcieńczenie (około 1,6 g L -1 i 0,125 g L -1odpowiednio) HDPE i PVC z 5-dniowego odcieku zaburzyły wzrost Prochlorococcus . Co więcej, transkrypcja genów związanych z produkcją pierwotną uległa znacznemu wpływowi, co wskazuje, że narażenie na odcieki ze zwykłych przedmiotów z tworzyw sztucznych może zaburzać fotosyntezę większości dominujących organizmów morskich.
Poprzez wszechobecne interakcje między mikroorganizmami a makroskopowymi roślinami i zwierzętami [ 92 , 93 ] tworzywa sztuczne i związane z nimi związki wywierają wieloraki pośredni wpływ biologiczny na mikrobiomy środowiskowe. Na przykład rośliny mogą zostać dotknięte, gdy pobierają tworzywa sztuczne, takie jak polistyren, przez swoje korzenie, zmieniając długość korzeni, wagę i reakcje na stres oksydacyjny, prawdopodobnie przez przerwanie porów w ścianie komórkowej i połączeń między komórkami wykorzystywanych do transportu składników odżywczych [ 94 , 95 ]. Taksonomia i zdrowotność roślin odgrywają ważną rolę w kształtowaniu mikrobiomów gleby i ryzosfery, wpływając na ilość i jakość wysięków z korzeni [ 96 ] oraz potencjał roślin do rekrutacji określonych członków mikrobiomu glebowego i promowania ekspresji genów, w tym tych wymaganych do chemotaksji i tworzenia biofilmu [ 97 ]. Tam, gdzie zaobserwowano, wpływ tworzyw sztucznych na skład i zdrowie zbiorowisk roślinnych i zwierzęcych prawdopodobnie będzie miał znaczący wpływ na mikrobiomy środowiskowe, ale jak dotąd nie ma wystarczających dowodów, aby sugerować silny związek. Wpływ mikroorganizmów na makroorganizmy jest rzadko wykrywany przy istotnych dla środowiska stężeniach mikrodrobin plastiku; Judy i in. [ 98 ] nie znaleźli dowodów na jakikolwiek wpływ mikrodrobin plastiku na wschody i produkcję siewek pszenicy ani na śmiertelność lub zachowanie populacji dżdżownic i nicieni.
Podczas gdy wiele badań koncentrowało się na wpływie tworzyw sztucznych na społeczności mikroorganizmów in situ, tworzywa sztuczne środowiskowe wpływają również na szybkość i zakres rozprzestrzeniania się drobnoustrojów w środowiskach. Tworzywa sztuczne unoszące się na wodzie, takie jak polietylen, polipropylen i polistyren, są przenoszone na duże odległości przez wiatry i prądy oceaniczne [ 99 ], podczas gdy tworzywa sztuczne nie unoszące się na wodzie, takie jak PET i PLA, mogą działać jako wektor przenoszący drobnoustroje związane z powierzchnią do głębszych wód [ 100 ]. Grupy mikroorganizmów, w tym toksyczne mikroalgi [ 101 ] oraz potencjalne patogeny ludzkie [ 75 ] i zwierzęce [ 102 ] zostały wykryte w związku z tworzywami sztucznymi pochodzącymi z wód morskich i słodkowodnych [ 73 , 103] wraz z różnymi taksonami opornymi na antybiotyki [ 104 ]. Postuluje się ponadto, że tworzywa sztuczne przenoszą patogeny przez oczyszczalnie ścieków [ 105 ], a gatunki szkodników przez wody balastowe [ 106 ]. Społeczności drobnoustrojów kolonizujące tworzywa sztuczne w środowisku prawdopodobnie pomagają larwom w osiedlaniu się i kolonizacji przez gatunki, w tym mszywioły i wieloszczety, pomagając w ten sposób w przemieszczaniu się inwazyjnych makroorganizmów morskich na całym świecie [ 107]. Tak więc, oprócz wspierania lub opóźniania wzrostu niektórych taksonów, środowiskowe tworzywa sztuczne prawdopodobnie odgrywają znaczącą rolę w rozprzestrzenianiu się zarówno drobnoustrojów, jak i organizmów wyższych w różnych skalach przestrzennych i typach siedlisk. Co ciekawe, mikrobiologiczna kolonizacja tworzyw sztucznych może również wpływać na wyporność cząstek i transport [ 108 , 109 ].
Ocena różnorodnych społeczności plastisfer za pomocą sekwencjonowania DNA amplikonu i metagenomu
Rozwój metod molekularnych, w tym technologii wysokowydajnego sekwencjonowania DNA, poszerza naszą wiedzę na temat różnorodnej natury mikrobiomów związanych z tworzywami sztucznymi. Chociaż żadne taksony nie kolonizują wyłącznie lub nawet w przeważającej mierze plastikowych powierzchni, wiele badań wykazało, w jaki sposób mikrobiomy plastikowych śmieci różnią się od tych obecnych w otaczającym środowisku [ 110 , 111 , 112 , 113 ], z nadreprezentacją w plastisferze gromad bakteryjnych, takich jak Proteobacteria, Bacteriodetes [ 114 ] i Cyanobacteria [ 115 ] oraz grzybów, takich jak Chytridiomycota [ 113]. Niemniej jednak, biorąc pod uwagę badania składu społeczności mikrobiomów plastisfery, które wciąż są w powijakach, pozostaje niejasne, w jakim stopniu istnieje podstawowa społeczność plastisfery i stopień, w jakim różni się ona od porównywalnych społeczności mikrobiomów w tym samym środowisku.
Z różnym skutkiem zbadano specyfikę zbiorowisk plastisfer w porównaniu ze zbiorowiskami rosnącymi na obojętnych powierzchniach, takich jak szkło i ceramika. Badanie przeprowadzone przez Oberbeckmanna i in. [ 116 ] stosując sekwencjonowanie amplikonu genu 16S rRNA do analizy taksonomicznej, nie znaleźli znaczącej różnicy między zbiorowiskami drobnoustrojów pelagicznych związanych z plastikowymi butelkami PET i szklanymi szkiełkami mikroskopowymi (jako kontrola) rozmieszczonymi przez 5-6 tygodni. Pinto i in. [ 117 ] stwierdzili również, że ogólne gromadzenie się społeczności na szkle było podobne wśród biofilmów rozwijających się na HDPE, LDPE i PP w okresie do 2 miesięcy, z rodzinami takimi jak Flavobacteriaceae, Phyllobacteriaceae, Planctomycetaceae i Rhodobacteraceaejest bardzo obfity na wszystkich powierzchniach. Takie odkrycia (patrz także Dang i in. [ 118 ]) prowadzą nas do założenia, że mogą nie istnieć żadne określone społeczności związane z tworzywami sztucznymi. Jednak pomimo braku różnic w całkowitym składzie zbiorowisk rosnących na szkle, HDPE, LDPE i PP (zwracając uwagę, że zaobserwowano jednak znaczące różnice w zbiorowiskach na PCW), Pinto i in. [ 117 ] zidentyfikowali podzbiór tych zbiorowisk inkubowanych po zanurzeniu w wodzie morskiej na okres do 2 miesięcy, który mimo to reagował na właściwości poszczególnych polimerów tworzyw sztucznych lub ich dodatków (patrz także Ogonowski i in. [ 119 ] oraz Kelly i in . [ 7 ]). Wyższa względna liczebność rodziny bakterii Rhodobacteraceaedyskryminowane zbiorowiska rosnące na HDPE i Sphingomonadaceae dla zbiorowisk rosnących na LDPE w porównaniu ze szkłem. Wykorzystując dłuższy okres inkubacji, Kirstein i in. [ 120 ] stwierdzili, że po 15 miesiącach w naturalnym systemie przepływowym wody morskiej biofilmy z HDPE, LDPE, PP, PS, PET, PLA, styren-akrylonitryl (SAN), prepolimer poliuretanowy (PESTUR) i PVC znacznie różniły się od społeczności uformowane na szkle. Podczas gdy zbiorowiska na PCW charakteryzowały się dużą liczebnością (> 5%) bakterii z rodzaju Flexithrix,różnice w obfitości innych taksonów specyficznych dla tworzyw sztucznych były w dużej mierze przypisywane zmianom w obecności i liczebności mniej dominujących OTU, co sugeruje, że rzadsze gatunki tworzą specyficzne związki z pewnymi rodzajami tworzyw sztucznych [ 121 ]. Popierając również pogląd, że mniej dominujący członkowie społeczności mogą bardziej szczegółowo reagować na obecność różnych tworzyw sztucznych, Erni-Cassola i in. [ 122 ] wykazali, że podczas dwudniowej inkubacji zwietrzały LDPE został wzbogacony o odrębną społeczność (szczególnie członków Roseobacter-, Oleiphilus- i Aestuariibacter-jak taksony) z nieprzetworzonego PE i szkła. Jednak to rozróżnienie nie było wykrywalne po 9 dniach, co sugeruje, że drobnoustroje specyficzne dla substratu obecne w plastisferze są szybko maskowane, gdy społeczność dojrzewa, a domniemane taksony specyficzne dla plastiku mają przewagę liczebną. Co ciekawe, chociaż znaczące różnice w składzie społeczności drobnoustrojów nie są konsekwentnie zgłaszane wśród społeczności rozwijających się na różnych tworzywach sztucznych, ostatnio uznano, że różne kolory tworzyw sztucznych są istotnym wyznacznikiem struktury społeczności drobnoustrojów plastisfery i różnorodności funkcjonalnej [ 123 ].
Do tej pory większość badań oceniających powstawanie i rozwój zbiorowisk plastisfer przeprowadzono w laboratoriach przy użyciu różnych rodzajów tworzyw sztucznych o różnym stanie (np . takie jak wyrzucone torby i butelki PET [ 116]). Biorąc pod uwagę długowieczność plastikowych śmieci w środowisku, stosunkowo krótkie okresy większości badań laboratoryjnych mogą nie wystarczyć do zbadania pełnego potencjału degradacyjnego mikrobiomu plastisfery. Środowiskowe tworzywa sztuczne zawierające dojrzałe mikrobiomy plastisfery zapewniają alternatywny sposób badania wielu czynników, które mogą wpływać na powstawanie plastisfery, takich jak skład tworzywa sztucznego, wiek i stan. Jednak charakterystyka starzejących się mikroplastików, które dominują w morskiej plastisferze pod względem liczebności, jest często ograniczona, ponieważ biomasa odzyskana z mikroplastików środowiskowych jest często bardzo niska, co ogranicza możliwości odzyskania wystarczającej ilości kwasów nukleinowych do analizy sekwencji. W rezultacie pozostaje wiele pytań bez odpowiedzi, w szczególności dotyczących plastisfery starzejących się mikroplastików środowiskowych.
Ponieważ nasza wiedza na temat mikroorganizmów obecnych w plastisferze jest coraz większa, wciąż pozostają bez odpowiedzi ważne pytania. (i) Które mikroorganizmy działają jako gatunki pionierskie, gdy tworzywo sztuczne jest po raz pierwszy wprowadzane do środowiska i czy priorytetowe skutki wczesnej kolonizacji wpływają na ogólny skład i potencjał metaboliczny społeczności drobnoustrojów w późniejszym czasie? Kwestie te mają szczególne znaczenie, ponieważ wzbogacenie organizmów degradujących tworzywa sztuczne może nastąpić głównie na wczesnych etapach kolonizacji, zanim nietrwałe substraty wytworzone w wyniku wietrzenia zostaną wyczerpane, a mikroorganizmy specyficzne dla tworzyw sztucznych zostaną zdominowane przez bardziej ogólne taksony zasiedlające biofilm [ 122 ].]. (ii) Czy istnieje podstawowa globalna społeczność taksonów degradujących tworzywa sztuczne, czy też wykazują one znaczną biogeografię geograficzną lub specyficzną dla danego siedliska? (iii) Jeśli główne elementy plastisfery różnią się liczebnością w zależności od rodzaju tworzywa sztucznego i dojrzałości biofilmu, czy obecność i liczebność niektórych mikroorganizmów może wskazywać przybliżony rodzaj i wiek plastikowych szczątków? Odpowiedzi na te pytania pomogą nam zidentyfikować mikroorganizmy specyficzne dla tworzyw sztucznych z różnych regionów, biomów, na różnych tworzywach sztucznych i na różnych etapach starzenia się i degradacji tworzyw sztucznych. Ponadto taka wiedza prawdopodobnie zwiększa naszą zdolność wykorzystania DNA społeczności drobnoustrojów do informowania o wpływie tworzyw sztucznych na środowisko (na przykład poprzez przyjęcie podejścia Hermansa i wsp. [ 125 ]).
Jak podkreślili Wright i in. [ 126 ] wiele badań scharakteryzowało plastisferę za pomocą analiz taksonomicznych [ 112 , 117 , 121 , 122 ], jednak nadal brakuje wiedzy dotyczącej potencjału funkcjonalnego tych społeczności. Bryanta i in. [ 115] byli jednymi z pierwszych, którzy zbadali potencjał metaboliczny mikrobiomu plastisfery za pomocą metagenomiki strzelby, wysuwając hipotezę, że genomy taksonów związanych z plastikiem byłyby bardziej wyraźne i wykazywałyby zwiększoną aktywność metaboliczną w porównaniu z wolno żyjącymi bakteriami w otaczającej wodzie morskiej. W porównaniu ze społecznością pikoplanktonu ich badania ujawniły zwiększoną liczbę genów kodujących chemotaksję i wiązanie azotu, a także kilka przypuszczalnych genów biodegradacji ksenobiotyków w społecznościach związanych z tworzywami sztucznymi. Obejmuje to gen kodujący 6-monooksygenazę 2,4-dichlorofenolu, hydroksylazę związaną z rozkładem chlorowanych zanieczyszczeń aromatycznych [ 127 ], czasami wytwarzaną w wyniku pirolizy polimerów i dodatków do tworzyw sztucznych [ 128]. Podobnie, badanie ujawniło zwiększoną obfitość wielu genów kodujących enzymy rozszczepiające pierścienie, takie jak 3,4-dioksygenaza protokatechuatu, a zwłaszcza 1,2-dioksygenaza homogentyzynianu, wcześniej związane z degradacją styrenu i wielopierścieniowych węglowodorów aromatycznych [ 129 ]. Podczas gdy Bryant i in. [ 115 ] nie byli w stanie potwierdzić, czy drobnoustroje w plastisferze są zdolne do degradacji polimeru tworzywa sztucznego, zwiększona liczebność genów kodujących degradację kilku ksenobiotyków może pomóc w identyfikacji nowych enzymów degradujących tworzywa sztuczne, a także taksonów wyrażających i wykorzystujących te enzymy. Podobnie jak w poprzednich badaniach, Pinnell i Turner [ 130] stwierdzili, że skład społeczności biofilmów związanych z PET pochodzących z paliw kopalnych jest nie do odróżnienia od biofilmów rosnących na ceramicznych kulkach rozmieszczonych na styku osad-woda przybrzeżnej laguny; w przeciwieństwie do tego społeczności drobnoustrojów związane z biogranulkami PHA były zdominowane przez organizmy redukujące siarczany. Analiza metagenomiczna społeczności związanych z bioplastikiem ujawniła znaczne zróżnicowanie filogenetyczne jednej depolimerazy, w szczególności depolimerazy polihydroksymaślanu (PHB), wraz z prawie 20-krotnym wzrostem liczebności genów depolimerazy, co sugeruje, że są one szeroko rozpowszechnione w biofilmie. Odnotowano również zwiększoną liczbę genów związanych z redukcją siarczanów i degradacją tworzyw sztucznych, takich jak depolimerazy, esterazy i reduktazy siarczanowe. Zatem,
Jest prawdopodobne, że społeczności współpracują ze sobą, aby uzyskać dostęp do węgla pochodzącego z tworzyw sztucznych; geny kodujące degradację alkanów, na przykład, są rozmieszczone w różnych zbiorowiskach organizmów hydrokarbonoklastycznych [ 131 ]. Lepsze zrozumienie dynamiki społeczności związanych z tworzywami sztucznymi można osiągnąć poprzez określenie wzorców współwystępowania i powiązań między różnymi organizmami i genami. Zaobserwowano, że toksyczne i słabo nietrwałe substraty węglowe silnie sprzyjają ułatwianiu wśród gatunków drobnoustrojów, tak że każdy z nich może lepiej rosnąć i degradować te substraty, aby przetrwać [ 132 ].]. Tam, gdzie przypuszcza się, że taksony lub produkty genów odgrywają korzystną rolę w degradacji tworzyw sztucznych, skorelowane wzrosty ich liczebności w wielu próbkach, jak wskazuje analiza sieciowa (np. patrz Gatica i in. [ 133 ]), mogą zidentyfikować inne organizmy i szlaki molekularne, które mogłyby skorzystać z reakcji społeczności na zanieczyszczenia tworzywami sztucznymi.
Łagodzenie zanieczyszczenia tworzywami sztucznymi przez mikrobiom jelitowy
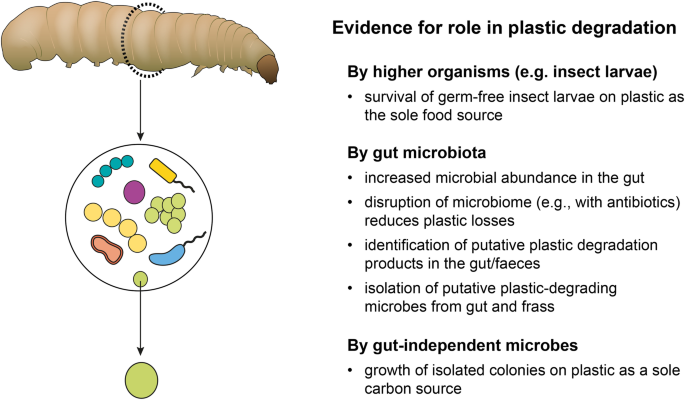
Ostatnio kilka gatunków owadów (szczególnie larwy ciemniaków, ćmy woskowej i ćmy mącznej) wzbudziło zainteresowanie ze względu na ich zdolność do konsumowania i degradacji różnorodnych polimerów z tworzyw sztucznych. Na przykład, larwy mącznika indyjskiego Plodia interpunctella mogą spożywać polistyren i wydają się być zdolne do rozkładu polistyrenu [ 134 ], podobnie jak larwy mącznika żółtego i olbrzymiego Tenebrio molitor i Zophrobas morio , odpowiednio [ 135 , 136 ]. Larwy mola woskowego większego [ 137 ] i mniejszego ( Galleria mellonella i Achroia grisella [ 138 ]]) są podobnie zgłaszane do degradacji odpowiednio polietylenu i polistyrenu. Analiza izotopowa dostarcza dowodów na to, że węgiel z tworzyw sztucznych, takich jak PE, jest włączany do biomasy bezkręgowców [ 139 ]. Pomimo wyników tych i innych badań, nadal nie jest pewne, w jakim stopniu organizmy wyższe lub związany z nimi mikrobiom przyczyniają się do degradacji polimerów z tworzyw sztucznych. Ponadto, stopień, w jakim te procesy biodegradacyjne mogą zostać przyspieszone przez synergistyczne efekty mikrobiomu gospodarza, pozostaje niejasny (ryc. 2 ).
Dowody na rolę owadów, drobnoustrojów związanych z żywicielem lub niezależnych od gospodarza, wolno żyjących drobnoustrojów w degradacji plastiku. Degradację plastikowego polimeru można wykryć różnymi metodami, w tym: [i] utrata masy tworzywa sztucznego, taka jak rozwój wyraźnych stref wokół kolonii na agarze z dodatkiem plastiku/pokryciu, [ii] zmienione właściwości powierzchni tworzywa sztucznego (np. skaningowej mikroskopii elektronowej) oraz [iii] wytwarzanie produktów degradacji (np. CO 2 , metabolity polimerów wykrywane za pomocą spektroskopii w podczerwieni z transformacją Fouriera lub wysokosprawnej chromatografii cieczowej)
Wiele organizmów spożywa tworzywa sztuczne przypadkowo i nie uzyskuje z nich żadnych wartości odżywczych; plastik został znaleziony w dużych ilościach w jelitach różnych organizmów, od ptaków morskich [ 22 ] i ryb [ 140 ] po robaki morskie i słodkowodne [ 36 , 141 ] i zooplankton [ 142 ]. Chociaż spożywanie tworzyw sztucznych przez gatunki, w tym dżdżownicę pospolitą Lumbricus terrestris, wiąże się ze zmniejszeniem rozkładu wielkości tworzyw sztucznych [ 143 ], w wielu przypadkach wykazanie degradacji tworzyw sztucznych, np. poprzez konwersję do CO 2 lub włączenie węgla związanego z tworzywami sztucznymi do biomasy zwierzęcej, jest bezpodstawne [ 144]. Podobnie „konsumpcja” tworzyw sztucznych przez larwy mącznika młynarka i woskowca zyskała wiele uwagi [ 30 , 145 ], ale potwierdzenie degradacji tworzyw sztucznych przez enzymy jelitowe żywicieli, niezależnie od mikrobiomu żywicieli, wymaga dalszych potwierdzeń [ 146 ]. W większości przypadków dopiero okaże się, czy żywiciel czerpie jakiekolwiek korzyści odżywcze z plastiku jako źródła energii; bez silniejszych dowodów na pełniejszą degradację w jelitach, fragmenty plastiku mogą jedynie powstawać w procesach mechanicznych (np. żucie) i wyrzucane do środowiska. Aby potwierdzić degradację plastiku przez makrobezkręgowce, pożądane są badania na organizmach wolnych od drobnoustrojów (tj. pozbawionych mikrobiomu), zwracając uwagę na fizjologiczną homeostazę organizmów, takich jakT. molitor są dotknięte przez powiązane zmiany w ekspresji enzymów trawiennych przez hodowle akseniczne [ 147 ]. Innym podejściem jest śledzenie losów znakowanego radioaktywnie (np . 13 C, 14 C) plastikowego polimeru poprzez włączenie do biomasy komórkowej lub produktów oddychania bezkręgowców konsumpcyjnych [ 139 ], najlepiej pod nieobecność taksonów drobnoustrojów żywiciela, aby również wyeliminować możliwość troficznej transfer węgla. Dotychczasowy brak dowodów na degradację plastiku przez larwy wolne od zarazków potwierdza natomiast, że mikroflora jest ważnym czynnikiem napędzającym degradację plastiku w jelitach bezkręgowców.
Ponieważ obecnie opisano różne domniemane taksony drobnoustrojów degradujące tworzywa sztuczne, w tym izolaty z mikroflory jelitowej [ 28 ], postawiono hipotezę, że enzymy taksonów drobnoustrojów związanych z jelitami, a nie enzymy gospodarza per se, działają najbardziej, jeśli nie w całości, na degradację plastiku przez konsumujące plastik taksony bezkręgowców. W serii eksperymentów Cassone i in. [ 148 ] dostarczyli wielu linii dowodów na degradację LDPE przez nienaruszony mikrobiom larw G. mellonella. Larwy G. mellonellachętnie konsumują wosk pszczeli, który pod pewnymi względami przypomina tworzywa sztuczne, takie jak PE, ponieważ składa się z różnorodnej mieszaniny długołańcuchowych węglowodorów. W związku z tym skłonność do konsumpcji tworzyw sztucznych może być związana ze strukturalnym lub chemicznym podobieństwem tworzyw sztucznych do ich preferowanego źródła pożywienia. Gąsienice karmione PE miały znacznie większą obfitość mikroorganizmów związanych z jelitami w porównaniu z osobnikami głodzonymi, a nawet organizmami karmionymi naturalną dietą z plastra miodu, co sugeruje, że ich mikroflora mogłaby odnieść korzyści z obfitości PE w jelitach. Gąsienice leczone antybiotykami karmione PE również wydalały tylko połowę stężenia glikolu etylenowego w porównaniu ze zwierzętami nieleczonymi. Ponieważ glikol etylenowy jest przypuszczalnym produktem ubocznym metabolizmu PE [ 30 ] wykorzystano to, aby zasugerować bezpośrednią rolę mikrobiomu jelitowego w degradacji PE. Zahamowanie depolimeryzacji plastiku po leczeniu antybiotykami zaobserwowano obecnie w licznych badaniach, co wskazuje, że sam organizm gospodarza jest słabo zdolny do wykorzystania plastiku jako źródła węgla lub energii lub jest przynajmniej częściowo zależny od swojego mikrobiomu jako źródła plastiku -enzymy degradujące [ 135 , 136 , 144 , 148 ]. Dostarczając dalszych dowodów na rolę drobnoustrojów w degradacji plastiku, Cassone i in. [ 148 ] wyizolowali i wyhodowali bakterie z jelit (zidentyfikowane jako Acinetobacter sp.) na podłożu bezwęglowym, uzupełnionym fragmentami PE. Kolejną obserwacją było to, żeAcinetobacter sp. był w stanie rozkładać tworzywa sztuczne w bardzo wolnym tempie tylko po wyizolowaniu z jelita, dostarczając dowodów na to, że degradacja tworzyw sztucznych jest maksymalizowana przez synergizmy występujące między żywicielem a społecznością mikrobiomów jelitowych, chociaż nie można lekceważyć znaczenia interakcji mikrobiologicznych w społeczności. Niemniej jednak stopień, w jakim larwy wpływają na strukturę polimeru z tworzywa sztucznego lub związanych z nim dodatków, lub poprawia korzystne cechy funkcjonalne jego mikroflory jelitowej, pozostaje obecnie niejasny.
Przed badaniem Cassone i in. [ 148 ] wielu autorów wyizolowało już przypuszczalne bakterie rozkładające tworzywa sztuczne z mikrobiomu jelitowego owadów. Yanga i in. [ 144 ] wyizolowali bakterię Exiguobacterium sp. Szczep YT2 z jelit larw mącznika karmionych styropianem i wykazał zdolność do wzrostu na folii polistyrenowej jako jedynym źródle węgla, co wiąże się ze zmianami topografii powierzchni i hydrofobowości tworzywa sztucznego. Utrata masy polistyrenu połączona ze spadkiem masy cząsteczkowej i uwalnianiem rozpuszczalnych w wodzie produktów degradacji została wykorzystana jako kolejny dowód na zdolność drobnoustrojów jelitowych do degradacji tworzyw sztucznych (odnotowując, że Danso i wsp. [ 29 ]] zastanawiają się, czy dostępne są wystarczające dowody potwierdzające degradację polimeru o dużej masie cząsteczkowej, tj. samego polistyrenu, a nie monomerów styrenu włączonych do matrycy polimerowej). Podobne badania implikują Aspergillus flavus, Bacillus sp. YP1 i Enterobacter asburiae YT1 wyizolowane z mikrobiomów jelitowych owadów jako zdolne do degradacji PE [ 134 , 149 ]. Chociaż takie odkrycia identyfikują możliwą rolę drobnoustrojów związanych z jelitami w degradacji plastiku, organizmy wyizolowane ze środowisk innych niż gospodarze są podobnie zdolne do degradacji plastiku i można je wykorzystać ze względu na ich zdolność do biodegradacji.
Łagodzenie zanieczyszczenia tworzywami sztucznymi przez mikrobiom środowiskowy
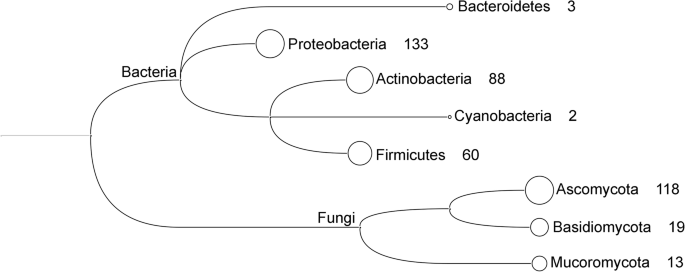
Pierwszy dowód na to, że wolno żyjące taksony środowiskowe przyczyniają się do degradacji plastiku, został opublikowany dopiero około 30 lat po pierwszej komercyjnej produkcji plastiku, w 1974 r., kiedy Fields i in. [ 150 ] wykazał, że grzyb Aureobasidium pullulans był zdolny do degradacji PCL. Od tego czasu znacznie wzrosła liczba mikroorganizmów uważanych za zdolne do biodegradacji tworzyw sztucznych. Niedawne badanie przeprowadzone przez Gambariniego i in. [ 28 ] podaje ponad 400 publikacji opisujących degradację 72 różnych typów tworzyw sztucznych przez 436 gatunków grzybów i bakterii. Przypuszczalnie zidentyfikowane dotychczas drobnoustroje rozkładające tworzywa sztuczne należą do pięciu rodzajów bakterii i trzech grzybów. Wśród gromad bakterii Proteobacteria ( n = 133), Actinobacteria (n = 88) i Firmicutes ( n = 60) mają największą liczbę zgłoszonych gatunków, podczas gdy Bacteroidetes ( n = 3) i sinice ( n = 2) mają znacznie mniej. Typy grzybów obejmują Ascomycota ( n = 118), Basidiomycota ( n = 19) i Mucoromycota ( n = 13) (ryc. 3 ).
Liczba domniemanych organizmów degradujących tworzywa sztuczne zgłoszona przez Gambariniego i in. [ 28 ], sklasyfikowane na poziomie typu. Liczba następująca po nazwie typu reprezentuje liczbę gatunków z tego konkretnego typu, które są zgłaszane jako degradujące tworzywa sztuczne
Jak wspomniano wcześniej, z mikrobiomów roślinnych i zwierzęcych wyizolowano niewielką liczbę drobnoustrojów rozkładających tworzywa sztuczne [ 149 , 151 , 152 ]. Jednak większość izolatów opisywanych w literaturze pochodziła z gleby [ 153 , 154 ] lub z miejsc przetwarzania odpadów, takich jak kompostownie [ 155 ] i wysypiska śmieci [ 156 ]. Dodatkowym źródłem są bakterie i grzyby już zdeponowane w kolekcjach kultur [ 157 ]. Wszystkie główne syntetyczne polimery mają gatunki powodujące ich degradację, na przykład PE [ 158 , 159 ], PET [ 160 , 161 ], PP [162 ], PS [ 163 ], PU [ 164 ] i PCW [ 165 ]. Jednak siła dowodów na degradację różni się w zależności od rodzaju tworzywa sztucznego. Do tej pory najbardziej wszechstronnie zbadano biodegradację PET. Godnym uwagi przykładem jest bakteria rozkładająca PET, Ideonella sakaiensis , wyizolowana z osadu w pobliżu japońskiego zakładu recyklingu butelek [ 161 ]. I. sakaiensis jest pierwszym organizmem, dla którego degradacja PET została dobrze opisana, a degradacja enzymatyczna PET została wyjaśniona, scharakteryzowana [ 166 ] i wzmocniona [ 167]. I odwrotnie, istnieją tylko słabe dowody na biodegradację polimerów syntetycznych, takich jak nylon, PP, PS i PVC. Na przykład biodegradacja oligomeru nylonu przez bakterię Agromyces sp. KY5R został pokazany przez Yasuhira i in. [ 168 ] zidentyfikowano geny i odpowiadające im enzymy odpowiedzialne za aktywność biodegradacji; jednak biodegradacja polimeru z tworzywa sztucznego (tj. nie tylko monomerów i oligomerów) nie została jeszcze potwierdzona.
Bioposzukiwanie nowych mechanizmów degradacji tworzyw sztucznych
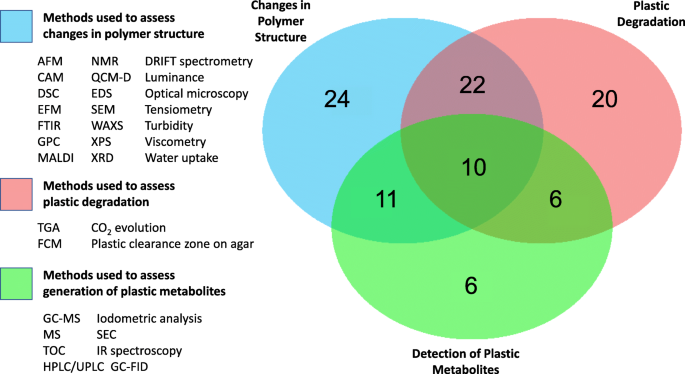
Obecnie brakuje informacji niezbędnych do krytycznej weryfikacji wielu doniesień o degradacji tworzyw sztucznych przez taksony lub społeczności drobnoustrojów lub do dokładnego odtworzenia wyników badań. Na przykład wiele raportów nie podaje żadnych informacji dotyczących składu polimeru i pomija szczegóły wypełniaczy i dodatków, które mogą być obecne w kompozytach polimerowych. Dlatego często nie jest możliwe rozróżnienie degradacji mikrobiologicznej polimerów tworzyw sztucznych od ich dodatków. Siła dowodów degradacji zależy również w dużym stopniu od zastosowanych technik, które można podzielić na trzy główne kategorie, wykrywające: (i) zmiany w strukturze polimeru, (ii) fizyczną utratę masy plastycznej oraz (iii) generowanie metabolitów tworzyw sztucznych. Najsilniejsze dowody na biodegradację tworzyw sztucznych można prawdopodobnie uzyskać przy użyciu kombinacji technik ze wszystkich trzech kategorii. Jednak analiza zbioru danych Gambariniego i in. [28 ], w którym zebrano dane z 408 badań, ujawniono, że wśród mikroorganizmów powodujących rozkład tworzyw sztucznych 48% opierało się na testach odnoszących się tylko do jednej z tych kategorii, 39% stosowało techniki obejmujące dwie kategorie, a tylko 10% wykorzystywało techniki, które obejmowały wszystkie trzy (ryc. 4 ).
Odsetek badań wykorzystujących dowody degradacji tworzyw sztucznych przez gatunki drobnoustrojów na podstawie: (i) zmian w strukturze polimeru (kolor niebieski), (ii) fizycznej utraty masy tworzywa sztucznego (kolor czerwony) lub (iii) wykrycia metabolitów tworzyw sztucznych (kolor zielony) lub te techniki w połączeniu. Dane zostały skompilowane przy użyciu
Większość doniesień o degradacji plastiku przez izolaty drobnoustrojów nie obejmuje badania genów i enzymów odpowiedzialnych za zgłaszaną aktywność. W rzeczywistości tylko około 14% mikroorganizmów, o których wiadomo, że rozkładają tworzywa sztuczne, ma wyjaśnione sekwencje genów nadające aktywność degradacji [ 28 ].]. Stanowi to poważną wadę, ponieważ znajomość odpowiednich danych biochemicznych i molekularnych zapewnia możliwość ogromnego postępu w dziedzinie biodegradacji tworzyw sztucznych, umożliwiając poszukiwanie nowych domniemanych genów degradujących tworzywa sztuczne w nowych mikrobiomach w porównaniu z danymi enzymów zgromadzonymi w strukturalnych i molekularnych bazach danych. W aktualnej literaturze często brakuje kluczowych informacji i procedur związanych ze zgłaszanymi substancjami degradującymi tworzywa sztuczne lub są one niekompletne, na przykład lokalizacja i warunki izolacji izolatu degradującego tworzywa sztuczne, siła dowodów na degradację, dokładna klasyfikacja taksonomiczna oraz brak zdeponowanych szczepów w bankach kultur. Nieodnosząc się do tych kwestii w odpowiedni sposób, doniesienia o degradacji tworzyw sztucznych, prawdopodobnie w większości dotychczas przeprowadzonych badań, należy traktować z ostrożnością.
Aby wykorzystać szeroką różnorodność fenotypową, która może już występować w naturalnych populacjach, przyszłe postępy w biodegradacji tworzyw sztucznych prawdopodobnie skorzystają na izolacji nowych mikroorganizmów z różnych społeczności mikrobiomów. Wymaga to rozważenia środowiska pobierania próbek i prawdopodobnych wymagań wzrostu organizmów w mikrobiomie, rodzaju tworzywa sztucznego będącego przedmiotem zainteresowania oraz testów empirycznych wymaganych do określenia biodegradacji polimeru związanej ze wzrostem. Przeglądając aktualną literaturę, zapewniamy przepływ pracy „najlepszych praktyk” metod niezbędnych do opisania ścieżek biodegradacji tworzyw sztucznych związanych ze wzrostem, zaczynając od odpowiedniego scharakteryzowania mikrobiomu plastisfery, a kończąc na identyfikacji genów i ścieżek biodegradacji tworzyw sztucznych (Tabela 1 ) .
| Przedmiot | Opis | Znaczenie | Przykłady najlepszych praktyk |
|---|---|---|---|
| Plastikowa tożsamość | Opisowa nazwa polimeru, masa cząsteczkowa i źródło. | Powtarzalność badania. | Almeida i in. [ 151 , 160 ] |
| Skład plastyczny | Kompletny skład polimerowy plus skład i ilość wszystkich dodatków i wypełniaczy. | Rozróżnienie degradacji polimeru i dodatków. | Montazera i in. [ 169 ], Novotný i in. [ 170 ] |
| Klasyfikacja taksonomiczna drobnoustrojów | Klasyfikacja taksonomiczna na podstawie dobrze scharakteryzowanych genów markerowych, takich jak pełne sekwencje genów 16S rRNA dla bakterii. | Odtwarzalność i ekstrapolacja wyników na pokrewne gatunki. Korzyści z badań nad dystrybucją filogenetyczną cech degradujących tworzywa sztuczne. | Novotný i in. [ 170 ], Hu i in. [ 171 ] |
| Środowisko i warunki izolacji | Lokalizacja izolacji szczepu i właściwości specyficzne dla miejsca, takie jak temperatura i pH. | Identyfikacja środowisk sprzyjających mikrobiologicznej degradacji tworzyw sztucznych. | Novotný i in. [ 170 ] |
| Dostępność szczepu | Deponowanie i opis wyizolowanych szczepów w międzynarodowych bankach kultur. | Pozwala na większą powtarzalność i dalsze badania przez innych badaczy. | Yoshida i in. [ 161 ] |
| Ocena degradacji tworzyw sztucznych | Opis technik zastosowanych do potwierdzenia degradacji, a najlepiej wykorzystanie wielu uzupełniających się metod (ryc. 4 ). | Potwierdzenie degradacji. Ważne jest, aby potwierdzić, w jaki sposób techniki rozróżniają degradację polimeru i dodatków, jeśli są one uwzględnione. | Yoshida i in. [ 161 , 164 ] |
| Enzymy rozkładające tworzywa sztuczne i identyfikacja genów | Identyfikacja enzymu odpowiedzialnego za degradację biologiczną i jego sekwencji genów. | Umożliwia eksplorację molekularnych baz danych, ekspresję rekombinowanych genów, optymalizację enzymów itp. | Kawai i in. [ 160 ], Yoshida i in. [ 161 ] |
Na podstawie badań nad mutagennością białek i analizy strukturalnej [ 166 ], obok przeszukiwania bazy danych homologii [ 28 ], jest prawdopodobne, że niektóre mikroorganizmy posiadają już geny degradacji plastiku, ale nie wykazują ich ekspresji in situ i/lub czerpią energię z łatwiejszych do wykorzystania źródeł węgla kiedy dostępny. Włączając obojętne kontrole (np. powierzchnie szklane lub ceramiczne), możemy być w stanie odróżnić geny nabyte i eksprymowane dla procesu degradacji plastiku od genów normalnie eksprymowanych w zbiorowiskach biofilmu (tj. także tam, gdzie nie ma plastiku). Yoshida i wsp., [ 161 ] wykazali, że I. sakaiensis posiada dwa geny kodujące enzymy rozkładające PET ( Is PETaza ijest MHETazą). Jednak nie odnieśli się do tego, czy Is PETaza może być wykorzystywana przez organizm do innych funkcji lub czy była używana in situ do degradacji PET w zakładzie recyklingu PET, z którego organizm został pierwotnie wyizolowany. Analizy strukturalne Is PETazy ujawniły , że enzym ma szerszą szczelinę miejsca aktywnego w porównaniu do przodków homologów kutynazy [ 166 ]. Zwężenie szczeliny miejsca aktywnego poprzez mutację aminokwasów miejsca aktywnego poprawiło degradację krystalicznego PET, co wskazuje, że jestPETaza nie została w pełni zoptymalizowana pod kątem metabolizmu PET. To, w połączeniu z początkowymi izolacjami skupiającymi się na amorficznym PET (1,9% krystalicznym) zamiast bardziej krystalicznym PET występującym w zakładach recyklingu butelek (15,7% krystaliczny; Yoshida i wsp. [ 161 ]) sugeruje, że pochodzenie pierwszego I. sakaiensis wyizolowany z zakładu recyklingu może być przypadkowy.
Same zmiany właściwości mechanicznych i struktury fizycznej polimeru, nawet obserwowane w połączeniu z produkcją biomasy drobnoustrojów, nie są wystarczającym dowodem na potwierdzenie biomineralizacji polimeru przez izolaty drobnoustrojów [ 172 ]. Należy również podać fizyczne ubytki masy plastycznej. Tworzywa sztuczne można dodawać do pożywek wzrostowych w postaci folii z tworzyw sztucznych, proszków lub granulek oraz emulgatorów. Pierwsze dwa podejścia są stosowane głównie do identyfikacji fizycznych zmian w strukturze polimeru i akumulacji biomasy jako pierwszych dowodów na degradację tworzyw sztucznych (tabela 1 ; ryc. 4 ).). Dowody degradacji polimerów z folii z tworzyw sztucznych lub granulek polimerowych wymagają przede wszystkim zmian chropowatości polimeru, powstawania dziur lub pęknięć, fragmentacji lub zmian koloru, potwierdzonych metodami wizualnymi, takimi jak skaningowa mikroskopia elektronowa (SEM), spektroskopia w podczerwieni z transformacją Fouriera (FTIR) [ 173 ] lub mikroskopii sił atomowych [ 174 ]. Jednak wizualne zmiany struktury powierzchni, zmiany masy plastycznej i właściwości mechanicznych nie dostarczają bezpośrednich dowodów na biodegradację [ 175 ], ponieważ tych zmian fizycznych nie można odróżnić od degradacji abiotycznej. Tam, gdzie wykazano biodegradację, prawdopodobne jest, że mikrobiomy działają w połączeniu z czynnikami abiotycznymi, wpływając na strukturalną integralność polimerów [ 176 ].]. Większość polimerów jest zbyt duża, aby przejść przez błony komórkowe i musi być początkowo zdepolimeryzowana (np. przez ciepło, światło widzialne i niewidzialne oraz tlen) [ 177 ]. Ponadto pomiar zmian w strukturze powierzchni lub masie cząsteczkowej tworzyw sztucznych nie rozróżnia degradacji polimerów lub ich dodatków [ 172 ]. Dlatego oprócz folii z tworzywa sztucznego i pożywek z granulatem zaleciliśmy, aby akumulacji biomasy na powierzchniach z tworzyw sztucznych i zmianom w strukturze polimeru towarzyszyło wykrywanie metabolitów tworzyw sztucznych w celu opisania biodegradacji związanej ze wzrostem.
Powszechną metodą oceny metabolizmu plastiku przez drobnoustroje jest obserwacja czystych stref w agarze zawierającym zemulgowany plastik [ 175 , 178 ]. Jednak emulgacje są zwykle ograniczone do tworzyw amorficznych lub tworzyw sztucznych o niższej masie cząsteczkowej, podczas gdy odpady środowiskowe, takie jak nylon, PE i PET, mają zwykle wyższą masę cząsteczkową, co ogranicza analizę tych zanieczyszczających tworzyw sztucznych. Ponadto udokumentowano, że rozpuszczalniki i środki powierzchniowo czynne powszechnie stosowane do tworzenia emulsji tworzyw sztucznych są rozkładane przez mikroorganizmy [ 179 , 180]. Dlatego obserwacja stref klirensu w pożywkach hodowlanych zawierających emulsje tworzyw sztucznych powinna być idealnie powiązana z innymi testami empirycznymi, takimi jak obserwacje włączania radioznakowanego węgla ze szkieletu polimeru do biomasy drobnoustrojów. Ponieważ tworzywa sztuczne zazwyczaj stanowią dominujące lub jedyne źródło węgla w testach metabolizmu tworzyw sztucznych, zwykle wymagane jest wykrycie tylko niewielkich ilości wydzielonego CO2, w celu wskazania metabolizmu polimeru [ 175 ]. Oprócz CO2, inne metabolity tworzyw sztucznych, które prawdopodobnie powstają podczas degradacji tworzyw sztucznych (np. produkcja tereftalanu mono-(2-hydroksyetylu) podczas hydrolizy PET) można zidentyfikować za pomocą metod takich jak chromatografia cieczowa/świetlna ze spektrometrią mas, która wykrywa wiele związków w jednym bieg analityczny [ 181 ]. Podejście to zastosowano w celu zbadania roli domniemanej depolimerazy w degradacji PHB przez Aspergillus fumigatus [ 182 ]. Podobnie, wykrywanie za pośrednictwem HPLC metabolitów degradacji PET, MHET i tereftalanu, dostarczyło dowodów na udział Is PETazy w degradacji PET [ 183]. Metody te, w połączeniu z podejściami zastosowanymi do wykrywania zmian w strukturze i metabolizmie polimeru (ryc. 4 ), dostarczają mocnych dowodów potwierdzających biodegradację tworzyw sztucznych.
Znajomość genów, o których wiadomo, że są związane z degradacją plastiku, stanowi silne narzędzie do identyfikacji nowych degradatorów i genów wśród społeczności mikrobiomów. Na przykład Danso i in. [ 29 ] opracowali ukryty model Markowa (HMM) do przeszukiwania baz danych genomu i metagenomu pod kątem obecności potencjalnych hydrolaz PET. Autorzy wykorzystali sekwencje z dziewięciu różnych enzymów o zweryfikowanej aktywności na substratach opartych na PET i zidentyfikowali 504 możliwych genów-kandydatów na hydrolazę PET. Badania takie jak to oraz praca Gambariniego i in. [ 28] wskazuje na ogromny potencjał eksploracji molekularnych baz danych dla genów odpowiedzialnych za degradację tworzyw sztucznych (PDG). Jednym z użytecznych podejść do eksperymentalnej weryfikacji PDG jest heterologiczna ekspresja genów kandydujących pochodzących z mikrobiomu w gospodarzu, który nie ma zdolności do degradacji pod nieobecność wprowadzonego genu, a następnie potwierdzenie fenotypu transformanta degradującego tworzywa sztuczne. Heterologiczna ekspresja u gospodarzy, takich jak Escherichia coli, została wykorzystana do weryfikacji fenotypów nadających degradację plastiku PDG kodujących domniemane depolimerazy PHB, esterazy, kutynazy, karboksyloesterazę i hydrolazy PET z wielu różnych bakterii i niektórych grzybów [ 29, 184, 185, 186]. Nadekspresja w heterologicznych gospodarzach jest również cennym narzędziem do oczyszczania wysokich poziomów enzymu do testów in vitro lub badania struktury krystalicznej enzymu. Innym podejściem jest zakłócenie lub wyciszenie kandydujących PDG w tle endogennym i ocena wpływu, jaki ma to na fenotyp degradacji plastiku. Eksploracja metagenomów przy użyciu podejścia genu kandydującego nie informuje o odkryciu zupełnie nowych wyznaczników lub czynników pomocniczych, które nie zostały wcześniej opisane. W tym scenariuszu badania poszczególnych szczepów degradujących oparte na genotypie i fenotypie są nadal ważne, aby zidentyfikować nowe determinanty, przy użyciu metod, takich jak przeszukiwanie biblioteki DNA w heterologicznych gospodarzach, losowa mutageneza lub różnicowa ekspresja transkryptu. Jednak po zidentyfikowaniu PDG,
Manipulowanie mikrobiomami w celu zwiększenia tempa i zakresu degradacji plastiku
Można zastosować różne strategie, aby przezwyciężyć wyzwania związane z izolowaniem mikroorganizmów zdolnych do wydajnej i/lub szybkiej degradacji plastiku. Na przykład wyższe temperatury mogą zwiększyć elastyczność zarówno amorficznych [ 187, 188 ], jak i krystalicznych domen łańcucha polimeru [ 189, 190, 191 ], poprawiając w ten sposób ich dostępność do ataku enzymatycznego [ 188 ]. Pod tym względem mikrobiomy termofilne stanowią obiecujące źródło enzymów, ponieważ prawdopodobnie będą bardziej termostabilne. W jednym z badań najbardziej termostabilny testowany enzym (kutynaza kompostowa z gałęzi liścia (LCC) uzyskana z niehodowanej bakterii [ 186 ]]) miały najwyższe tempo depolimeryzacji PET w temperaturze 65°C [ 192 ]. Tempo degradacji uległo dalszemu zwiększeniu po poprawie termostabilności enzymu poprzez mutagenezę specyficzną dla miejsca. Jednak do tej pory tylko ~ 10% izolowanych badań degradacji tworzyw sztucznych wykazało degradację polimeru w temperaturach ≥50°C, a tylko niewielka część (~ 0,5%) z nich została wyizolowana z ekstremalnych środowisk, takich jak gorące źródła, komposty i beztlenowe komory fermentacyjne [ 28 ]. Wydaje się, że istnieją znaczne możliwości wydobywania mikrobiomów termofilnych i ekstremofilnych jako obiecującego źródła przypuszczalnych enzymów i mikroorganizmów rozkładających tworzywa sztuczne.
Wyższa różnorodność genotypowa i fenotypowa obecna w zbiorowiskach drobnoustrojów w porównaniu z pojedynczymi szczepami drobnoustrojów może oznaczać, że zbiorowiska skuteczniej rozkładają ksenobiotyczne zanieczyszczenia [ 193 ]. W związku z tym sztuczne konsorcja utworzone przez wybranie niewielkiej liczby mikroorganizmów rozkładających tworzywa sztuczne w ramach już istniejącego konsorcjum (tj. przy użyciu podejścia odgórnego [ 194 ]) lub połączenie oddzielnie wyizolowanych szczepów drobnoustrojów (tj. przy użyciu podejścia oddolnego [ 162]) może być użyteczną strategią poprawy biodegradacji tworzyw sztucznych. Alternatywnie, ukierunkowana mutageneza w celu poprawy ekspresji genów i funkcji enzymów, wraz z narzędziami inżynierii metabolicznej i biologii syntetycznej, może zostać wykorzystana do uzyskania bardziej wydajnych konsorcjów rozkładających tworzywa sztuczne. W szczególności wprowadzenie lub modyfikacja międzygatunkowych interakcji mikrobiologicznych (takich jak komunikacja międzykomórkowa poprzez wymianę metabolitów) może zostać wykorzystana do stworzenia konsorcjów o ulepszonych cechach biodegradacji [ 195 , 196]. Ponadto segmentacja szlaków metabolicznych między szczepami, tak że każdy organizm wytwarza związek pośredni, który może być wykorzystany przez następny organizm na szlaku, może być wykorzystana do zmniejszenia obciążenia metabolicznego dowolnego organizmu. Ponieważ dostępne są tylko ograniczone informacje dotyczące genów i enzymów biorących udział w biodegradacji tworzyw sztucznych [ 28 ], konieczne jest najpierw lepsze zrozumienie szlaków degradacji przez pojedyncze szczepy i szlaki kodegradacji wielu szczepów, aby ułatwić to podejście.
Wnioski
Wpływ globalnego zanieczyszczenia tworzywami sztucznymi na mikrobiomy jest zróżnicowany, począwszy od bezpośrednich konsekwencji toksycznych odcieków na zdrowie i aktywność społeczności drobnoustrojów, po pośredni wpływ tworzyw sztucznych na organizmy gospodarzy i środowiska. Wiele setek gatunków drobnoustrojów, genów i enzymów bierze udział w degradacji plastiku. W przypadku niewielkiej liczby tworzyw pochodzenia biologicznego, takich jak PLA, przedstawiono wyraźne dowody na ich degradację mikrobiologiczną. Jednak w przypadku większości komercyjnych tworzyw sztucznych dowody na degradację mikrobiologiczną pozostają słabe, a badania nie potwierdzają wzrostu drobnoustrojów na syntetycznym polimerze. Aby zapewnić prawidłową identyfikację taksonów i enzymów degradujących tworzywa sztuczne, ułatwiając ich ulepszanie poprzez manipulacje środowiskowe, biotyczne i genetyczne, należy przedstawić wiele linii dowodów na degradację tworzyw sztucznych. Najlepiej byłoby, gdyby obejmowało to dowody na zmiany w strukturze polimeru, utratę masy i wykrycie produktów degradacji, wraz z potwierdzeniem szczepu drobnoustrojów i przypuszczalnych enzymów rozkładających tworzywa sztuczne oraz powiązanych genów. Takie szczegóły są niezbędne do wiarygodnego odróżnienia organizmów i enzymów zdolnych do degradacji tworzyw sztucznych od tych, które są zdolne jedynie do degradacji bardziej nietrwałego węgla w głównie amorficznych tworzywach sztucznych, monomerach tworzyw sztucznych, wypełniaczach i dodatkach.
Skróty
- KRZYWKA:
- Pomiar kąta zwilżania
- Spektroskopia DRIFT:
- Spektroskopia z transformacją Fouriera w podczerwieni z odbiciem rozproszonym
- DSC:
- Różnicowa kalorymetria skaningowa
- EDS:
- Spektroskopia z dyspersją energii
- EFM:
- Mikroskopia epifluorescencyjna
- FCM:
- Cytometrii przepływowej
- FTIR:
- Spektroskopia w podczerwieni z transformacją Fouriera
- GC-FID:
- Chromatografia gazowa z detekcją płomieniowo-jonizacyjną
- GC-MS:
- Chromatografia gazowa-spektrometria mas
- GPC:
- Chromatografia żelowo-permeacyjna
- HDPE:
- Polietylen o dużej gęstości
- HPLC:
- Wysokosprawna chromatografia cieczowa
- Spektroskopia w podczerwieni:
- Spektroskopia w podczerwieni
- LDPE:
- Polietylen o niskiej gęstości
- LLDPE:
- Liniowy polietylen o małej gęstości
- MALDI:
- Desorpcja/jonizacja laserowa wspomagana matrycą
- MHET:
- Tereftalan mono-2-hydroksyetylu
- MHETaza:
- Enzym hydrolaza, który rozszczepia MHET
- SM:
- Spekrtometria masy
- NMR:
- Magnetyczny rezonans jądrowy
- PBAT:
- Politereftalan adypinianu butylenu
- PCL:
- polikaprolakton
- PE:
- Polietylen
- GROSZEK:
- poliesteracetal
- KOŁEK:
- Glikol polietylenowy
- PSZ:
- poliestrosulfon
- PESU:
- Polieterosulfon
- ZWIERZĘ DOMOWE:
- Politereftalan etylenu
- PHA:
- polihydroksyalkanian
- BZ:
- polihydroksymaślan
- PHBV:
- Poli (3-hydroksymaślan-ko-3-hydroksywalerianian)
- PHO:
- Polihydroksyoktanian
- PLA:
- Kwas polimlekowy
- PMCL:
- Poli(4-metylo-ε-kaprolakton)
- PS:
- Polistyren
- PP:
- Polipropylen
- PU:
- poliuretan
- PVA:
- Alkohol poliwinylowy
- PCW:
- Chlorek winylu
- QCM-D:
- Mikrowaga kwarcowa z monitorowaniem rozpraszania
- RDS:
- Dynamiczny spektrometr reometryczny
- SEK:
- Chromatografia wykluczania ze względu na wielkość
- SEM:
- Skaningowa mikroskopia elektronowa
- Spis treści:
- Całkowity węgiel organiczny
- TGA:
- Analiza termograwimetryczna
- TPA:
- Kwas tereftalowy
- UPLC:
- Ultrawydajna chromatografia cieczowa
- WOSKI:
- Szerokokątne rozpraszanie promieniowania rentgenowskiego
- XPS:
- Spektroskopia fotoelektronowa rentgenowska
- XRD:
- Proszkowa dyfrakcja rentgenowska
Bibliografia
-
Lithner D, Larsson A, Dave G. Ranking zagrożeń dla środowiska i zdrowia oraz ocena polimerów tworzyw sztucznych na podstawie składu chemicznego. Sci Total Environ. 2011;409(18):3309–24.
-
Geyer R. Rozdział 2 – Produkcja, zastosowanie i los polimerów syntetycznych. W: Letcher TM, wyd. Odpady z tworzyw sztucznych i recykling. Oksford: prasa akademicka; 2020: 13–32.
-
Geyer R, Jambeck JR, Prawo KL. Produkcja, zastosowanie i los wszystkich tworzyw sztucznych, jakie kiedykolwiek powstały. adw. nauk ścisłych 2017;3(7):e1700782.
-
Europejskie biotworzywa. Dane dotyczące rynku bioplastików 2018. Berlin: European Bioplastics; 2018.
-
Lau WWY, Shiran Y, Bailey RM, Cook E, Stuchtey MR, Koskella J i in. Ocena scenariuszy prowadzących do zerowego zanieczyszczenia tworzywami sztucznymi. Nauki ścisłe. 2020;369(6510):1455-61.
-
Toussaint B, Raffael B, Angers-Loustau A, Gilliland D, Kestens V, Petrillo M i in. Przegląd zanieczyszczeń mikro- i nanoplastikami w łańcuchu pokarmowym. Food Addit Contam Part A. 2019;36(5):639–73.
-
Kelly JJ, London MG, Oforji N, Ogunsola A, Hoellein TJ. Mikroplastik wybiera zbieżne mikrobiomy z różnych źródeł rzecznych. nauka słodkowodna. 2020;39(2):281–91.
-
Hoellein TJ, McCormick AR, Hittie J, London MG, Scott JW, Kelly JJ. Podłużne wzorce koncentracji mikroplastiku i zespołów bakteryjnych w siedliskach powierzchniowych i bentosowych rzeki miejskiej. nauka słodkowodna. 2017;36(3):491–507.
-
Chiba S, Saito H, Fletcher R, Yogi T, Kayo M, Miyagi S i in. Ludzki ślad w otchłani: 30-letnie zapisy plastikowych śmieci w głębinach morskich. Polityka marcowa. 2018;96:204–12.
-
Van Cauwenberghe L, Vanreusel A, Mees J, Janssen CR. Zanieczyszczenie mikroplastikiem w osadach głębinowych. Zanieczyszczenie środowiska. 2013;182:495–9.
-
Bergmann M, Mützel S, Primpke S, Tekman MB, Trachsel J, Gerdts G. Biały i cudowny? Mikroplastiki przeważają w śniegu od Alp po Arktykę. adw. nauk ścisłych 2019;5(8):eaax1157.
-
Lamb JB, Willis BL, Fiorenza EA, Couch CS, Howard R, Rader DN i in. Odpady z tworzyw sztucznych związane z chorobami raf koralowych. Nauki ścisłe. 2018;359(6374):460–2.
-
Laganà P, Caruso G, Corsi I, Bergami E, Venuti V, Majolino D i in. Czy tworzywa sztuczne służą jako możliwy wektor rozprzestrzeniania się oporności na antybiotyki? Pierwsze spostrzeżenia dotyczące bakterii związanych z kawałkiem polistyrenu z Wyspy Króla Jerzego (Antarktyda). Int J Hyg Environ Health. 2019;222(1):89–100.
-
Borunda A. Ten młody wieloryb zmarł z 88 funtami plastiku w żołądku. Natl Geogr Mag. 2019 (18 marca). https://www.nationalgeographic.com/environment/2019/03/whale-dies-88-pounds-plastic-philippines/#close .
-
Beachum L. Martwy kaszalot miał w żołądku 220 funtów śmieci, w tym linę, plastik i rękawiczki. Wahington DC: The Washington Post; 2019.
-
Brentano R, Petry MV. Spożycie szczątków morskich i wpływ człowieka na kaszalota karłowatego (Kogia breviceps) w południowej Brazylii. Mar Pollut Bull. 2020;150:5.
-
Moore RC, Loseto L, Noel M, Etemadifar A, Brewster JD, MacPhee S i in. Mikroplastiki w wielorybach bieługi (Delphinapterus leucas) ze wschodniego Morza Beauforta. Mar Pollut Bull. 2020;150:7.
-
Deudero S, Alomar C. Zagrożona bioróżnorodność morska Morza Śródziemnego: przegląd wpływu odpadów morskich na gatunki. Mar Pollut Bull. 2015;98(1-2):58–68.
-
Li RL, Zhang SP, Zhang LL, Yu KF, Wang SP, Wang YH. Badania terenowe zanieczyszczeń mikroplastikiem w ślimakach morskich (Ellobium chinense) z lasów namorzynowych i ich związków z mikroplastikami w wodzie/osadzie położonym na północ od zatoki Beibu. Zanieczyszczenie środowiska. 2020;263:8.
-
Nelms SE, Parry HE, Bennett KA, Galloway TS, Godley BJ, Santillo D i in. To, co wchodzi, musi wyjść: połączenie analizy diety molekularnej opartej na odchodach i kwantyfikacji połkniętych mikrodrobin plastiku u drapieżnika morskiego. Metody Ecol Evol. 2019;10(10):1712–22.
-
Santos RG, Andrades R, Demetrio GR, Kuwai GM, Sobral MF, Vieira JDS i in. Badanie sytości wywołanej plastikiem podczas żerowania żółwi zielonych. Zanieczyszczenie środowiska. 2020;265(Pkt B):114918.
-
Wilcox C, Van Sebille E, Hardesty BD. Zagrożenie ptaków morskich zanieczyszczeniem tworzywami sztucznymi jest globalne, wszechobecne i wzrasta. Proc Natl Acad Sci US A. 2015;112(38):11899–904.
-
Jemec A, Horvat P, Kunej U, Bele M, Krzan A. Wchłanianie i wpływ mikroplastycznych włókien tekstylnych na słodkowodne skorupiaki Daphnia magna. Zanieczyszczenie środowiska. 2016;219:201–9.
-
Lei L, Wu S, Lu S, Liu M, Song Y, Fu Z i in. Cząsteczki mikroplastiku powodują uszkodzenie jelit i inne niekorzystne skutki u danio pręgowanego Danio rerio i nicieni Caenorhabditis elegans . Sci Total Environ. 2018;619-620:1-8.
-
Farrell P, Nelson K. Transfer poziomu troficznego mikroplastiku: Mytilus edulis (L.) do. Carcinus maenas (L.). Zanieczyszczenie środowiska. 2013;177:1–3.
-
Browne MA, Dissanayake A, Galloway TS, Lowe DM, Thompson R. Połknięty mikroskopijny plastik przemieszcza się do układu krążenia małży, Mytilus edulis (L). Environ Sci Technol. 2008;42(13):5026–31.
-
Nelms SE, Galloway TS, Godley BJ, Jarvis DS, Lindeque PK. Badanie transferu troficznego mikroplastiku u drapieżników morskich. Zanieczyszczenie środowiska. 2018;238:999–1007.
-
Gambarini V, Pantos O, Kingsbury JM, Weaver L, Handley KM, Lear G. Zaktualizowany rozkład filogenetyczny organizmów i enzymów rozkładających tworzywa sztuczne. mSystemy. 2020;.
-
Danso D, Chow J, Streit WR. Tworzywa sztuczne: środowiskowe i biotechnologiczne perspektywy degradacji mikrobiologicznej. Appl Environ Microbiol. 2019;85(19):14.
-
Bombelli P, Howe CJ, Bertocchini F. Biodegradacja polietylenu przez gąsienice ćmy woskowej galleria mellonella. Curr Biol. 2017;27:R283–R93.
-
Tetu SG, Sarker I, Schrameyer V, Pickford R, Elbourne LDH, Moore LR i in. Odcieki z tworzyw sztucznych zaburzają wzrost i produkcję tlenu u Prochlorococcus, najliczniejszej bakterii fotosyntetyzującej w oceanie. Biol komunalny. 2019;2:Artykuł nr: 184.
-
Partensky F, Hess WR, Vaulot D. Prochlorococcus, morski fotosyntetyczny prokariot o znaczeniu globalnym. Microbiol Mol Biol Rev. 1999;63(1):106–27.
-
Flombaum P, Gallegos JL, Gordillo RA, Rincón J, Zabala LL, Jiao N i in. Obecne i przyszłe globalne rozmieszczenie morskich sinic Prochlorococcus i Synechococcus. Proc Natl Acad Sci US A. 2013;110(24):9824-9.
-
Feng D, Zhang H, Jiang X, Zou J, Li Q, Mai H i in. Ekspozycja na bisfenol A indukuje dysbiozę mikroflory jelitowej iw konsekwencji aktywację osi jelitowo-wątrobowej prowadzącą do stłuszczenia wątroby u myszy CD-1. Zanieczyszczenie środowiska. 2020;265(Pt A):114880.
-
Okrągły JL, Mazmański SK. Mikroflora jelitowa kształtuje odpowiedzi immunologiczne jelit w okresie zdrowia i choroby. Nat Rev Immunol. 2009;9(5):313–23.
-
Wright SL, Rowe D, Thompson RC, Galloway TS. Spożycie mikroplastiku zmniejsza rezerwy energii u robaków morskich. Curr Biol. 2013;23(23):R1031–R3.
-
Besseling E, Wegner A, Foekema EM, van den Heuvel-Greve MJ, Koelmans AA. Wpływ mikroplastiku na kondycję i bioakumulację PCB przez lugworm Arenicola marina (L.). Environ Sci Technol. 2013;47(1):593–600.
-
Lee KW, Shim WJ, Kwon OY, Kang J. Zależne od wielkości skutki cząstek mikrostyropianu w widłonogach morskich Tigriopus japonicus. Environ Sci Technol. 2013;47:11278–83.
-
Jacobsen JK, Massey L, Gulland F. Śmiertelne połknięcie pływających szczątków przez dwa kaszaloty (Physeter macrocephalus). Mar Pollut Bull. 2010;60:765–7.
-
Secci ER, Zarzur S. Plastikowe szczątki połknięte przez wieloryba dziobowatego z Blainville, Mesoplodon densirotris, wyrzucone na brzeg w Brazylii. Aquat Mamm. 1999;25:21–4.
-
Wilcox C, Puckridge M, Schuyler QA, Townsend K, Hardesty BD. Analiza ilościowa łącząca śmiertelność żółwi morskich i spożycie plastikowych śmieci. Przedstawiciel nauki 2018;8:12536.
-
Ryan PG, Moore CJ, van Franeker JA, Moloney CL. Monitorowanie obfitości plastikowych śmieci w środowisku morskim. Philos Trans Phys Sci inż. 2009;364:1999–2012.
-
Avio CG, Gorbi S, Milan M, Benedetti M, Fattorini D, d’Errico G, et al. Biodostępność zanieczyszczeń i ryzyko toksykologiczne od mikrodrobin plastiku po małże morskie. Zanieczyszczenie środowiska. 2015;198:211–22.
-
Collard F, Gilbert B, Compère P, Eppe G, Das K, Jauiaux T i in. Mikroplastiki w wątróbkach europejskich sardeli (Engraulis encrasicolus, L.). Zanieczyszczenie środowiska. 2017;229:1000–5.
-
Deng Y, Zhang Y, Lemos B, Ren H. Akumulacja mikroplastiku w tkankach myszy i reakcje biomarkerów sugerują powszechne ryzyko zdrowotne związane z narażeniem. Przedstawiciel Sci 2017;7:46687.
-
von Moos N, Burkhardt-Holm P, Köhler A. Wychwyt i wpływ mikroplastików na komórki i tkanki omułka błękitnego Mytilus edulis L. po ekspozycji eksperymentalnej. Environ Sci Technol. 2012;46(20):11327–35.
-
Winter SE, Bäumler AJ. Dysbioza w zapalonym jelicie: przypadek sprzyja przygotowanemu drobnoustrojowi. Mikroby jelitowe. 2014;5:71–3.
-
Jing TZ, Qi FH, Wang ZY. Najbardziej dominujące role bakterii jelitowych owadów: trawienie, detoksykacja lub dostarczanie niezbędnych składników odżywczych? Mikrobiom. 2020;8(1):38.
-
Velmurugan G, Ramprasath T, Swaminathan K, Mithieux G, Rajendhran J, Dhivakar M i in. Degradacja drobnoustrojów jelitowych insektycydów fosforoorganicznych – indukuje nietolerancję glukozy poprzez glukoneogenezę. Genom Biol. 2017;18(1):8.
-
Kamada N, Chen GY, Inohara N, Núñez G. Kontrola patogenów i patogenów przez mikroflorę jelitową. Nat Immunol. 2013;14(7):685–90.
-
Teuten EL, Saquing JM, Knappe DRU, Barlaz MA, Jonsson S, Bjorn A, et al. Transport i uwalnianie chemikaliów z tworzyw sztucznych do środowiska i dzikiej przyrody. Philos Trans R Soc B-Biol Sci. 2009;364(1526):2027–45.
-
Kim EJ, Kim JW, Lee SK. Hamowanie rozwoju oocytów w japońskiej Medaka (Oryzias latipes) narażonych na działanie ftalanu di-2-etyloheksylu. Environ Int. 2002;28(5):359–65.
-
Yin L, Yan LP, He B, Fang YJ, Liu XY, Duan CG i in. Toksyczne działanie plastyfikatora, ftalanu dibutylu, na jądra szczurów. Int J Clin Exp Pathol. 2016;9(11):11246–53.
-
Ohtani H, Miura I, Ichikawa Y. Wpływ ftalanu dibutylu jako środowiskowego czynnika zaburzającego gospodarkę hormonalną na różnicowanie płci gonad genetycznych samców żaby Rana rugosa. Środowiskowa Perspektywa Zdrowotna. 2000;108(12):1189–93.
-
Lahnsteiner F, Berger B, Kletzl M, Weismann T. Wpływ bisfenolu a na dojrzewanie i jakość nasienia i jaj pstrąga potokowego, Salmo trutta f. fario. Aquat Toxicol. 2005;75:213–24.
-
Mandich A, Bottero S, Benfenati E, Cevasco A, Erratico C, Maggioni S i in. Ekspozycja in vivo karpi na stopniowane stężenia bisfenolu a. Gen Comp Endokrynol. 2007;153(1):15–24.
-
Oehlmann J, Schulte-Oehlmann U, Kloas W, Jagnytsch O, Lutz I, Kusk KO i in. Krytyczna analiza biologicznego wpływu plastyfikatorów na dziką przyrodę. Philos Trans R Soc Lond Ser B Biol Sci. 2009;364(1526):2047–62.
-
Balbi T, Franzellitti S, Fabbri R, Montagna M, Fabbri E, Canesi L. Wpływ bisfenolu a (BPA) na wczesny rozwój zarodka w omułku morskim Mytilus galloprovincialis: wpływ na transkrypcję genów. Zanieczyszczenie środowiska. 2016;218:996–1004.
-
Savabieasfahani M, Kannan K, Astapova O, Evans NP, Padmanabhan V. Programowanie rozwojowe: zróżnicowane skutki prenatalnej ekspozycji na bisfenol-a lub metoksychlor na funkcje rozrodcze. Endokrynol. 2006;147:5956–66.
-
Rubin BS, Murray MK, Damassa DA, King JC, Soto AM. Okołoporodowa ekspozycja na niskie dawki bisfenolu A wpływa na masę ciała, wzorce cykliczności rujowej i poziomy LH w osoczu. Środowiskowa Perspektywa Zdrowotna. 2001;109:675–80.
-
Rios LM, Jones PR, Moore C, Narayan UV. Oznaczenie ilościowe trwałych zanieczyszczeń organicznych zaadsorbowanych na plastikowych odpadkach z „wschodniego obszaru śmieci” na północnym Pacyfiku. J Environ Monit. 2010;12(12):2226–36.
-
Mato Y, Isobe T, Takada H, Kanehiro H, Ohtake C, Kaminuma T. Plastikowe granulki żywicy jako medium transportujące toksyczne chemikalia w środowisku morskim. Environ Sci Technol. 2001;35(2):318–24.
-
Ryan PG, Connell AD, Gardner BD. Spożycie plastiku i PCB u ptaków morskich: czy istnieje związek? Mar Pollut Bull. 1988;19(4):174-6.
-
Li HX, Getzinger GJ, Ferguson PL, Orihuela B, Zhu M, Rittschof D. Wpływ toksycznych odcieków z komercyjnych tworzyw sztucznych na przeżycie larw i osadnictwo pąkli Amphibalanus amphitrite. Environ Sci Technol. 2016;50(2):924–31.
-
Adamovsky O, Buerger AN, Vespalcova H, Sohag SR, Hanlon AT, Ginn PE i in. Ocena relacji mikrobiom-gospodarz w układzie żołądkowo-jelitowym danio pręgowanego ujawnia, że odporność nabyta jest celem narażenia na ftalan bis (2-etyloheksylu) (DEHP). Environ Sci Technol. 2020;54:5719–28.
-
Badanie rynku Ceresana. Badanie rynku: plastyfikatory (wydanie 5), tom. 2019. Niemcy: Ceresana Ltd; 2017. s. 350.
-
Chen LG, Guo YY, Hu CY, Lam PKS, Lam JCW, Zhou BS. Dysbioza mikroflory jelitowej przez chroniczną współekspozycję na nanocząstki dwutlenku tytanu i bisfenol A: implikacje dla zdrowia gospodarza u danio pręgowanego. Zanieczyszczenie środowiska. 2018;234:307–17.
-
Javurek AB, Spollen WG, Johnson SA, Bivens NJ, Bromert KH, Givan SA i in. Wpływ narażenia na bisfenol a i etynyloestradiol na mikroflorę jelitową rodziców i ich potomstwa w modelu gryzoni. Mikroby jelitowe. 2016;7(6):471–85.
-
Lai KP, Chung YT, Li R, Wan HT, Wong CK-C. Bisfenol a zmienia mikrobiom jelitowy: porównawcza analiza metagenomiczna. Zanieczyszczenie środowiska. 2016;218:923–30.
-
Xu J, Huang GN, Nagy T, Teng Q, Guo TL. Zależny od płci wpływ bisfenolu a na rozwój cukrzycy typu 1 u myszy z cukrzycą bez otyłości (NOD). Arch Toxicol. 2019;93(4):997–1008.
-
DeLuca JAA, Allred KF, Menon R, Riordan R, Weeks BR, Jayaraman A i in. Bisfenol-a zmienia metabolity mikroflory pochodzące z aminokwasów aromatycznych i pogarsza aktywność choroby podczas zapalenia jelita grubego. Exp Biol Med. 2018;243(10):864–75.
-
Morgan XC, Tickle TL, Sokol H, Gevers D, Devaney KL, Ward DV i in. Dysfunkcja mikrobiomu jelitowego w nieswoistych zapaleniach jelit i ich leczeniu. Genom Biol. 2012;13:R79.
-
Kirstein IV, Kirmizi S, Wichels A, Garin-Fernandez A, Erler R, Löder M, et al. Niebezpieczni autostopowicze? Dowody na potencjalnie patogenne Vibrio spp. na cząsteczkach mikroplastiku. Mar Environ Res. 2016;120:1–8.
-
Fackelmann G, Sommer S. Mikroplastiki i mikrobiom jelitowy: w jaki sposób chronicznie narażone gatunki mogą cierpieć z powodu dysbiozy jelitowej. Mar Pollut Bull. 2019;143:193–203.
-
Zettler ER, Mincer TJ, Amaral-Zettler LA. Życie w „plastysferze”: społeczności drobnoustrojów na plastikowych szczątkach morskich. Environ Sci Technol. 2013;47(13):7137–46.
-
Steinmetz Z, Wollmann C, Schaefer M, Buchmann C, David J, Troeger J i in. Ściółkowanie tworzyw sztucznych w rolnictwie. Wymieniać krótkoterminowe korzyści agronomiczne na długoterminową degradację gleby? Sci Total Environ. 2016;550:690–705.
-
Huang Y, Liu Q, Jia W, Yan C, Wang J. Ściółkowanie tworzyw sztucznych w rolnictwie jako źródło mikrodrobin plastiku w środowisku lądowym. Zanieczyszczenie środowiska. 2020;260:114096.
-
Serrano-Ruiz H, Martin-Closas L, Pelacho AM. Biodegradowalne ściółki z tworzyw sztucznych: wpływ na rolnicze środowisko biotyczne. Sci Total Environ. 2021;750:141228.
-
Machado AAD, Lau CW, Kloas W, Bergmann J, Bacheher JB, Faltin E i in. Mikroplastiki mogą zmieniać właściwości gleby i wpływać na wydajność roślin. Environ Sci Technol. 2019;53(10):6044–52.
-
Drenovsky RE, Vo D, Graham KJ, Scow KM. Zawartość wody w glebie i dostępność węgla organicznego są głównymi determinantami składu społeczności drobnoustrojów glebowych. Microb Ecol. 2004;48(3):424–30.
-
Davidson EA, Belk E, Boone RD. Zawartość wody w glebie i temperatura jako niezależne lub uwikłane czynniki kontrolujące oddychanie gleby w mieszanym lesie liściastym w strefie umiarkowanej. Glob Chang Biol. 1998;4(2):217–27.
-
Qi YL, Ossowicki A, Yang XM, Lwanga EH, Dini-Andreote F, Geissen V i in. Wpływ resztek plastikowej folii ściółkowej na ryzosferę pszenicy i właściwości gleby. J Hazard Mater. 2020;387:7.
-
Sjollema SB, Redondo-Hasselerharm P, Leslie HA, Kraak MHS, Vethaak AD. Czy cząsteczki plastiku wpływają na fotosyntezę i wzrost mikroglonów? Aquat Toxicol. 2016;170:259–61.
-
Besseling E, Wang B, Lürling M, Koelmans AA. Nanoplastik wpływa na wzrost S. obliquus i reprodukcję D. magna. Environ Sci Technol. 2014;48:12336–43.
-
Li C, Moore-Kucera J, Lee J, Corbin A, Brodhagen M, Miles C i in. Wpływ biodegradowalnego ściółki na jakość gleby. Appl Soil Ecol. 2014;79:59–69.
-
Muroi F, Tachibana Y, Kobayashi Y, Sakurai T. Kasuya Ki. wpływ poli(kotereftalanu adypinianu butylenu) na mikroflorę glebową i wzrost roślin. Pchnięcie Poly Degrad. 2016;129:338–46.
-
Kong S, Ji Y, Liu L, Chen L, Zhao X, Wang J i in. Różnorodność estrów ftalanów w podmiejskich glebach rolniczych i nieużytkach pojawiła się wraz z urbanizacją w Chinach. Zanieczyszczenie środowiska. 2012;170:161–8.
-
Kong X, Jin D, Jin S, Wang Z, Yin H, Xu M i in. Reakcje społeczności bakteryjnej na zanieczyszczenie ftalanem dibutylu w ekosystemie glebowo-roślinnym. J Hazard Mater. 2018;353:142–50.
-
Xie HJ, Shi YJ, Zhang J, Cui Y, Teng SX, Wang SG i in. Degradacja estrów ftalanowych (PAE) w glebie i wpływ PAE na aktywność mikrokosmosu glebowego. J Chem Technol Biotechnologia. 2010;85(8):1108–16.
-
Cartwright CD, Thompson IP, Burns RG. Degradacja i wpływ plastyfikatorów ftalanowych na zbiorowiska drobnoustrojów glebowych. Environ Toxicol Chem. 2009;19(5):1253–61.
-
Hahladakis JN, Velis CA, Weber R, Iacovidou E, Purnell P. Przegląd chemicznych dodatków obecnych w tworzywach sztucznych: migracja, uwalnianie, losy i wpływ na środowisko podczas ich użytkowania, utylizacji i recyklingu. J Hazard Mater. 2018;344:179–99.
-
Herrera Paredes S, Lebeis SL. Oddawanie społeczności: mikrobiologiczne mechanizmy interakcji roślina-gleba. Przód Ecol. 2016;30(7):1043–52.
-
Bray N, Wikings K. Role bezkręgowców w mikrobiomie gleby miejskiej. Przedni Ecol Evol. 2019;7:359.
-
Jiang X, Chen H, Liao Y, Ye Z, Li M, Klobučar G. Ekotoksyczność i genotoksyczność mikroplastików polistyrenu na roślinach wyższych Vicia faba. Zanieczyszczenie środowiska. 2019;250:831–8.
-
Kalčíková G, Žgajnar Gotvajn A, Kladnik A, Jemec A. Wpływ mikrokulek polietylenowych na pływającą roślinę słodkowodną lemat minor. Zanieczyszczenie środowiska. 2017;230:1108–15.
-
Zhang C, Liu GB, Xue S, Song ZL. Aktywność mikrobiologiczna gleby ryzosfery pod różnymi typami roślinności na płaskowyżu lessowym w Chinach. Geoderma. 2011;161(3-4):115-25.
-
Pérez-Jaramillo JE, Mendes R, Raaijmakers JM. Wpływ udomowienia roślin na montaż i funkcje mikrobiomu ryzosfery. Roślinny Mol Biol. 2016;90:635–44.
-
Judy JD, Williams M, Gregg A, Oliver D, Kumar A, Kookana R i in. Mikrodrobiny plastiku w odpadach organicznych pochodzących z odpadów komunalnych powodują minimalną toksyczność krótko- i długoterminową u kluczowych fauny i flory lądowej. Zanieczyszczenie środowiska. 2019;252:522–31.
-
Lacerda ALDF, Rodrigues LDS, van Sebille E, Rodrigues FL, Ribeiro L, Secchi ER i in. Tworzywa sztuczne w morskich wodach powierzchniowych wokół Półwyspu Antarktycznego. Przedstawiciel nauki 2019;9:3977.
-
Audrézet F, Zaiko A, Lear G, Wood SA, Tremblay LA, Pochon X. Implikacje bezpieczeństwa biologicznego dryfujących morskich odpadów z tworzyw sztucznych: obecna wiedza i przyszłe badania. Mar Pollut Bull. 2020:111835. https://doi.org/10.1016/j.marpolbul.2020.111835 .
-
Casabianca S, Capellacci S, Giacobbe MG, Dell’Aversano C, Tartaglione L, Varriale F, et al. Szkodliwe skupiska mikroglonów związane z tworzywami sztucznymi w środowisku morskim. Zanieczyszczenie środowiska. 2019;244:617–26.
-
Goldstein MC, Carson HS, Eriksen M. Związek różnorodności i obszaru siedlisk w społecznościach raftingowych związanych z tworzywami sztucznymi na północnym Pacyfiku. Mar Biol. 2014;161:1441–53.
-
McCormick A, Hoellein TJ, Mason SA, Schluep J, Kelly JJ. Mikroplastik to obfite i wyraźne siedlisko drobnoustrojów w rzece miejskiej. Environ Sci Technol. 2014;48:11863–71.
-
Moore RE, Millar BC, Moore JE. Odporność na środki przeciwdrobnoustrojowe (AMR) i morskie tworzywa sztuczne: czy odpady z opakowań żywności mogą działać jako mechanizm rozprzestrzeniania się oporności na środki przeciwdrobnoustrojowe w środowiskach oceanicznych? Mar Pollut Bull. 2020;150:7.
-
Bowley J, Baker-Austin C, Porter A, Hartnell R, Lewis C. Oceanic autostopowicze – ocena ryzyka patogenów z morskiego mikroplastiku. Trendy Mikrobiol. 2020; https://doi.org/10.1016/j.tim.2020.06.011 .
-
Naik RK, Naik MM, D’Costa PM, Shaikh F. Mikroplastiki w wodach balastowych jako nowe źródło i wektor szkodliwych chemikaliów, antybiotyków, metali, patogenów bakteryjnych i gatunków HAB: potencjalne zagrożenie dla środowiska morskiego i zdrowia ludzi. Mar Pollut Bull. 2019;149:110525.
-
Barnes DKA. Różnorodność biologiczna – inwazje życia morskiego na plastikowe śmieci. Natura. 2002;416:808–9.
-
Hoellein TJ, Shogren AJ, Tank JL, Risteca P, Kelly JJ. Szybkość osadzania się mikroplastików w strumieniach jest zgodna z wzorcami dla naturalnie występujących cząstek allochtonicznych. Przedstawiciel nauki 2019;9:3740.
-
Kooi M, van Nes EH, Scheffer M, Koelmans AA. Wzloty i upadki w oceanie: wpływ biofoulingu na pionowy transport mikrodrobin plastiku. Environ Sci Technol. 2017;51(14):7963–71.
-
Debroas D, Mone A, Ter Halle A. Tworzywa sztuczne w plamie śmieci na północnym Atlantyku: mikrob łodzi dla autostopowiczów i degradatorów plastiku. Sci Total Environ. 2017;599-600:1222-32.
-
Oberbeckmann S, Kreikemeyer B, Labrenz M. Czynniki środowiskowe sprzyjają powstawaniu specyficznych skupisk bakterii na mikroplastikach. Przedni mikrobiol. 2017;8:2709.
-
Dussud C, Meistertzheim AL, Conan P, Pujo-Pay M, George M, Fabre P i in. Dowody podziału nisz wśród bakterii żyjących na tworzywach sztucznych, cząstkach organicznych i otaczających wodach morskich. Zanieczyszczenie środowiska. 2018;236:807–16.
-
Kettner MT, Rojas-Jimenez K, Oberbeckmann S, Labrenz M, Grossart HP. Mikroplastiki zmieniają skład zbiorowisk grzybów w ekosystemach wodnych. Mikrobiol środowiskowy. 2017;19(11):4447–59.
-
Oberbeckmann S, Loeder MGJ, Gerdts G, Osborn AM. Przestrzenna i sezonowa zmienność różnorodności i struktury biofilmów mikrobiologicznych na morskich tworzywach sztucznych w wodach północnej Europy. FEMS Microbiol Ecol. 2014;90(2):478–92.
-
Bryant JA, Clemente TM, Viviani DA, Fong AA, Thomas KA, Kemp P i in. Różnorodność i aktywność społeczności zamieszkujących plastikowe odpady w Wirze Północnego Pacyfiku. mSystemy. 2016;1(3):e00024–16.
-
Oberbeckmann S, Osborn AM, Duhaime MB. Drobnoustroje na butelce: podłoże, pora roku i położenie geograficzne wpływają na skład społeczności drobnoustrojów kolonizujących plastikowe odpady morskie. PLoS Jeden. 2016;11(8):e0159289.
-
Pinto M, Langer TM, Huffer T, Hofmann T, Herndl GJ. Skład zbiorowisk bakteryjnych związanych z biofilmami z tworzyw sztucznych różni się w zależności od polimerów i etapów sukcesji biofilmu. PLoS Jeden. 2019;14(6):e0217165.
-
Dang H, Li T, Chen M, Huang G. Rozmieszczenie między oceanami bakterii Rhodobacterales jako głównych kolonizatorów powierzchniowych w umiarkowanych przybrzeżnych wodach morskich. Appl Environ Microbiol. 2008;74(1):52–60.
-
Ogonowski M, Motiei A, Ininbergs K, Hell E, Gerdes Z, Udekwu KI, et al. Dowody na selektywną strukturę społeczności bakteryjnej na mikroplastiku. Mikrobiol środowiskowy. 2018;20(8):2796–808.
-
Kirstein IV, Wichels A, Krohne G, Gerdts G. Dojrzałe zbiorowiska biofilmu na syntetycznych polimerach w wodzie morskiej – specyficzne czy ogólne? Mar Environ Res. 2018;142:147–54.
-
Kirstein IV, Wichels A, Gullans E, Krohne G, Gerdts G. Plastisphere – Odkrywanie ściśle przylegających do plastiku „specyficznych” mikroorganizmów. PLoS Jeden. 2019;14(4):e0215859–e.
-
Erni-Cassola G, Wright RJ, Gibson MI, Christie-Oleza JA. Wczesna kolonizacja zwietrzałego polietylenu przez różne bakterie w morskiej wodzie morskiej przybrzeżnej. Microb Ecol. 2020;79(3):517–26.
-
Wen B, Liu JH, Zhang Y, Zhang HR, Gao JZ, Chen ZZ. Struktura społeczności i różnorodność funkcjonalna plastisfery w wodach akwakultury: czy kolor plastiku ma znaczenie? Sci Total Environ. 2020;740:140082.
-
Harrison JP, Schratzberger M, Sapp M, Osborn AM. Szybka kolonizacja bakteryjna mikroplastików z polietylenu o małej gęstości w mikrokosmosach osadów przybrzeżnych. Mikrobiol BMC. 2014;14:232.
-
Hermans SM, Buckley HL, Case BS, Curran-Cournane F, Taylor M, Lear G. Wykorzystanie zbiorowisk bakterii glebowych do przewidywania zmiennych fizykochemicznych i jakości gleby. Mikrobiom. 2020;8(1):79.
-
Wright RJ, Erni-Cassola G, Zadjelovic V, Latva M, Christie-Oleza JA. Morskie szczątki z tworzyw sztucznych: nowa powierzchnia do kolonizacji drobnoustrojów. Environ Sci Technol. 2020; 54(19):11657-72.
-
Ledger T, Pieper DH, Gonzalez B. Hydroksylazy chlorofenolowe kodowane przez plazmid pJP4 w różny sposób przyczyniają się do degradacji kwasu chlorofenoksyoctowego. Appl Environ Microbiol. 2006;72(4):2783–92.
-
Blankenship A, Chang DPY, Jones AD, Kelly PB, Kennedy IM, Matsumura F i in. Toksyczne produkty uboczne spalania ze spalania chlorowanych węglowodorów i tworzyw sztucznych. Chemosfera. 1994;28(1):183–96.
-
Cao J, Lai Q, Yuan J, Shao Z. Analiza genomowa i metaboliczna szlaku degradacji fluorantenu w Celeribacter indicus P73T. Przedstawiciel Sci 2015;5:7741.
-
Pinnell LJ, Turner JW. Metagenomika strzelby ujawnia reakcję społeczności drobnoustrojów bentosowych na tworzywa sztuczne i bioplastiki w przybrzeżnym środowisku morskim. Przedni mikrobiol. 2019;1:1252.
-
Wang W, Shao Z. Enzymy i geny zaangażowane w tlenową degradację alkanów. Przedni mikrobiol. 2013;4:artykuł 116.
-
Piccardi P, Vessman B, Mitri S. Toksyczność napędza ułatwienie między 4 gatunkami bakterii. Proc Natl Acad Sci USA A. 2019;116(32):15979–84.
-
Gatica J, Jurkevitch E, Cytryn E. Metagenomika porównawcza i analizy sieci dostarczają nowych informacji na temat zakresu i rozmieszczenia homologów β-laktamazy w środowisku. Przedni mikrobiol. 2019;10:146.
-
Yang J, Yang Y, Wu WM, Zhao J, Jiang L. Dowody biodegradacji polietylenu przez szczepy bakteryjne z jelit jedzących plastik woskowców. Environ Sci Technol. 2014;48(23):13776–84.
-
Peng BY, Su YM, Chen ZB, Chen JB, Zhou XF, Benbow ME i in. Biodegradacja polistyrenu przez ciemne (Tenebrio obscurus) i żółte (Tenebrio molitor) mączniki (Coleoptera: Tenebrionidae). Environ Sci Technol. 2019;53(9):5256–65.
-
Yang Y, Wang JL, Xia ML. Biodegradacja i mineralizacja polistyrenu przez żywiące się plastikiem superrobaki Zophobas atratus. Sci Total Environ. 2020;708:7.
-
Lou Y, Ekaterina P, Yang SS, Lu BY, Liu BF, Ren NQ i in. Biodegradacja polietylenu i polistyrenu przez larwy mola woskowego (Galleria mellonella L.) oraz wpływ suplementacji diety na rdzenny mikrobiom jelitowy. Environ Sci Technol. 2020;54(5):2821–31.
-
Kundungal H, Gangarapu M, Sarangapani S, Patchaiyappan A, Devipriya SP. Skuteczna biodegradacja odpadów polietylenowych (HDPE) przez jedzącego tworzywa sztuczne woskowiny (Achroia grisella). Environ Sci Pollut Res. 2019;26:18509–19.
-
Taipale SJ, Peltomaa E, Kukkonen JVK, Kainz MJ, Kautonen P, Tiirola M. Śledzenie losów mikroplastikowego węgla w wodnej sieci troficznej za pomocą analizy izotopów specyficznych dla związku. Przedstawiciel nauki 2019;9:19894.
-
Lusher AL, McHugh M, Thompson RC. Występowanie mikrodrobin plastiku w przewodzie pokarmowym ryb pelagicznych i dennych z kanału La Manche. Mar Pollut Bull. 2013;67(1-2):94-9.
-
Hurley RR, Woodward JC, Rothwell JJ. Spożycie mikroplastików przez słodkowodne robaki tubifex. Environ Sci Technol. 2017;51(21):12844–51.
-
Cole M, Lindeque P, Fileman E, Halsband C, Goodhead R, Moger J. Połknięcie mikroplastiku przez zooplankton. Environ Sci Technol. 2013;47(12):6646–55.
-
Huerta Lwanga E, Gertsen H, Gooren H, Peters P, Salánki T, van der Ploeg M, et al. Mikroplastik w ekosystemie lądowym: implikacje dla Lumbricus terrestris (Oligochaeta, Lumbricidae). Environ Sci Technol. 2016;50:2685–91.
-
Yang Y, Yang J, Wu WM, Zhao J, Song YL, Gao LC i in. Biodegradacja i mineralizacja polistyrenu przez żywiące się plastikiem larwy mącznika: część 2. Rola mikroorganizmów jelitowych. Environ Sci Technol. 2015;49(20):12087–93.
-
Brandon AM, El Abbadi SH, Ibekwe UA, Cho YM, Wu WM, Criddle CS. Los heksabromocyklododekanu (HBCD), powszechnego środka zmniejszającego palność, w robakach mącznika rozkładających polistyren: podwyższone poziomy HBCD w egestowanym polimerze, ale bez bioakumulacji. Environ Sci Technol. 2020;54(1):364–71.
-
Kong HG, Kim HH, Chung JH, Jun J, Lee SB, Kim HM i in. Hologenom galleria mellonella wspiera niezależny od mikrobiomu metabolizm wosku pszczelego o długich łańcuchach węglowodorów. Przedstawiciel komórki 2019;26:2451–64.
-
Vigneron A, Jehan C, Rigaud T, Moret Y. Ochrona immunologiczna pożytecznego szkodnika: chrząszcza mącznika młynarka, Tenebrio molitor . fizjoterapeuta. 2019;10:138.
-
Cassone BJ, Grove HC, Elebute O, Villanueva SMP, LeMoine CMR. Rola mikrobiomu jelitowego w degradacji polietylenu o małej gęstości przez larwy gąsienic ćmy woskowej większej, galleria mellonella. Proc R Soc B-Biol Sci. 2020;287(1922):9.
-
Zhang JQ, Gao DL, Li QH, Zhao YX, Li L, Lin HF i in. Biodegradacja cząstek mikroplastiku polietylenu przez grzyba Aspergillus flavus z wnętrzności ćmy woskowej galleria mellonella. Sci Total Environ. 2020;704:8.
-
Fields RD, Rodriguez F, Finn RK. Degradacja mikrobiologiczna poliestrów: Polikaprolakton rozkładany przez P. pullulans. J Appl Polym Sci. 1974;18:3571–9.
-
Almeida EL, Carrillo Rincón AF, Jackson SA, Dobson ADW. Badania przesiewowe in silico i heterologiczna ekspresja enzymu podobnego do hydrolazy politereftalanu etylenu (PETazy) (SM14est) o aktywności degradującej polikaprolakton (PCL), ze szczepu Streptomyces sp. pochodzącego z gąbki morskiej. SM14. Przedni mikrobiol. 2019;10:2187.
-
Koitabashi M, Noguchi MT, Sameshima-Yamashita Y, Hiradate S, Suzuki K, Yoshida S i in. Degradacja biodegradowalnych plastikowych folii ściółkowych w środowisku glebowym przez grzyby liściaste wyizolowane z roślin trawiastych. AM Ekspres. 2012;2(1):40.
-
Mergaert J, Webb A, Anderson C, Wouters A, Swings J. Degradacja mikrobiologiczna poli (3-hydroksymaślanu) i poli (3-hydroksymaślanu-co-3-hydroksywalerianianu) w glebach. Appl Environ Microbiol. 1993;59(10):3233-8.
-
Shahreza H, Sepahy AA, Hosseini F, Nejad RK. Identyfikacja molekularna szczepów Pseudomonas zdolnych do degradacji polietylenu z gleby oraz klonowanie genu alkB. Praktyka Arch Pharm. 2019;10:43–8.
-
Kleeberg I, Hetz C, Kroppenstedt RM, Müller RJ, Deckwer WD. Biodegradacja kopoliestrów alifatyczno-aromatycznych przez Thermomonospora fusca i inne termofilne izolaty kompostu. Appl Environ Microbiol. 1998;64(5):1731-5.
-
Gajendiran A, Krishnamoorthy S, Abraham J. Degradacja mikrobiologiczna polietylenu o małej gęstości (LDPE) przez Aspergillus clavatus szczep JASK1 wyizolowany z gleby składowiska. 3 Biotechnologia. 2016;6(1):52.
-
da Luz JMR, Paes SA, Bazzolli DMS, Tótola MR, Demuner AJ, Kasuya MCM. Abiotyczna i biotyczna degradacja oksybiodegradowalnych toreb foliowych przez Pleurotus ostreatus. PLoS Jeden. 2014;9(11):e107438.
-
Montazer Z, Habibi Najafi MB, Levin DB. Degradacja mikrobiologiczna polietylenu małej gęstości i synteza polimerów polihydroksyalkanianowych. Can J Microbiol. 2019;65(3):224–34.
-
Skariyachan S, Manjunatha V, Sultana S, Jois C, Bai V, Vasist KS. Nowe konsorcja bakteryjne wyizolowane z obszarów przetwarzania plastikowych śmieci wykazały zwiększoną degradację polietylenu o niskiej gęstości. Environ Sci Pollut Res. 2016;23(18):18307–19.
-
Kawai F, Oda M, Tamashiro T, Waku T, Tanaka N, Yamamoto M i in. Nowatorska aktywowana Ca 2+ , termostabilizowana poliestraza zdolna do hydrolizy politereftalanu etylenu z Saccharomonospora viridis AHK190. Appl Microbiol Biotechnol. 2014;98(24):10053–64.
-
Yoshida S, Hiraga K, Takehana T, Taniguchi I, Yamaji H, Maeda Y i in. Bakteria rozkładająca i asymilująca poli(tereftalan etylenu). Nauki ścisłe. 2016;351:1196–9.
-
Skariyachan S, Patil AA, Shankar A, Manjunath M, Bachappanavar N, Kiran S. Zwiększona degradacja polimerów polietylenu i polipropylenu przez nowe termofilne konsorcja Brevibacillus sps. i Aneurinibacillus sp. odseparowane od składowisk odpadów i oczyszczalni ścieków. Pchnięcie Poly Degrad. 2018;149:52–68.
-
Tian L, Kolvenbach B, Corvini N, Wang S, Tavanaie N, Wang L i in. Mineralizacja tworzyw polistyrenowych znakowanych 14C przez Penicillium variabile po wstępnej obróbce ozonowaniem. Nowa biotechnologia. 2017;38:101–5.
-
Hung CS, Zingarelli S, Nadeau LJ, Biffinger JC, Drake CA, Crouch AL i in. Represja katabolitu węglowego i degradacja poliuretanu Impranil w szczepie Pseudomonas protegens Pf-5. Appl Environ Microbiol. 2016;82(20):6080–90.
-
Sumathi T, Viswanath B, Sri Lakshmi A, SaiGopal DVR. Wytwarzanie lakazy przez Cochliobolus sp. wyizolowanych z plastikowych gleb składowanych i ich zdolność do degradacji PCW o małej masie cząsteczkowej. Biochem Res Int. 2016;2016:9519527.
-
Austin HP, Allen MD, Donohoe BS, Rorrer NA, Kearns FL, Silveira RL i in. Charakterystyka i inżynieria aromatycznej poliestrazy degradującej tworzywa sztuczne. Proc Natl Acad Sci US A. 2018;115(19):E4350–E7.
-
Son HF, Cho IJ, Joo S, Seo H, Sagong HY, Choi SY i in. Racjonalna inżynieria białek termostabilnej PETazy z Ideonella sakaiensis do wysoce wydajnej degradacji PET. Katal ACS. 2019;9(4):3519–26.
-
Yasuhira K, Uedo Y, Takeo M, Kato DI, Negoro S. Organizacja genetyczna enzymów degradujących oligomer nylonu z bakterii alkofilnych, Agromyces sp. KY5R. J Biosci Bioeng. 2007;104(6):521–4.
-
Montazer Z, Habibi-Najafi MB, Mohebbi M, Oromiehei A. Degradacja mikrobiologiczna folii polietylenowych o niskiej gęstości poddanych wstępnej obróbce UV przez nowe bakterie rozkładające polietylen wyizolowane z gleby z wysypisk tworzyw sztucznych. J Polym Environ. 2018;26(9):3613–25.
-
Novotný Č, Malachová K, Adamus G, Kwiecień M, Lotti N, Soccio M, et al. Degradacja napromieniania/obrobionego w wysokiej temperaturze liniowego polietylenu o małej gęstości (LLDPE) przez Bacillus amyloliquefaciens. Int Biodeterior Biodegradacja. 2018;132:259–67.
-
Hu X, Osaki S, Hayashi M, Kaku M, Katuen S, Kobayashi H i in. Degradacja poliestru zawierającego tereftalan przez termofilne promieniowce i gatunki Bacillus pochodzące z kompostów. J Polym Environ. 2008;16(2):103–8.
-
Oberbeckmann S, Labrenz M. Morskie zespoły drobnoustrojów na mikroplastikach: różnorodność, adaptacja i rola w degradacji; 2020. s. 209–32.
-
Watanabe T, Ohtake Y, Asabe H, Murakami N, Furukawa M. Biodegradowalność i degradacja drobnoustrojów polietylenu o małej gęstości. J Appl Polym Sci. 2009;111(1):551–9.
-
Ikada E. Obserwacja biodegradacji polimerów za pomocą mikroskopu elektronowego. J Environ Polym Degrad. 1999;7(4):197–201.
-
Shah AA, Hasan F, Hameed A, Ahmed S. Biologiczna degradacja tworzyw sztucznych: kompleksowy przegląd. adw. biotechnologii 2008;26(3):246–65.
-
Mierzwa-Hersztek M, Gondek K, Kopeć M. Degradacja polietylenu i materiałów polimerowych pochodzenia biokomponentowego: przegląd. J Polym Environ. 2019;27(3):600–11.
-
Swift GJHobpHA, Amsterdam. Niemedyczne polimery biodegradowalne: polimery ulegające biodegradacji w środowisku. W: Domb AJ, Kost J, Wiseman DM, redaktorzy. Podręcznik polimerów biodegradowalnych. Amsterdam: wydawcy akademiccy Harwood; 1997. s. 473–511.
-
Nishida H, Tokiwa Y. Dystrybucja poli (β-hydroksymaślanu) i poli (ε-kaprolaktonu) tlenowych mikroorganizmów degradujących w różnych środowiskach. J Environ Polym Degrad. 1993;1(3):227–33.
-
Li M, Shi Y, Li Y, Sun Y, Song C, Huang Z i in. Zmiana różnorodności mikrobiologicznej i funkcji w filtrze biozraszającym o wysokiej wydajności do oczyszczania gazowego ksylenu. J Air Waste Manag Doc. 2019;69(9):1059–69.
-
Scott MJ, Jones MN. Biodegradacja surfaktantów w środowisku. Biochim Biophys Acta Biomembr. 2000;1508(1):235–51.
-
Pitt J.J. Zasady i zastosowania chromatografii cieczowej ze spektrometrią mas w biochemii klinicznej. Clin Biochem Rev. 2009;30(1):19–34.
-
Jung HW, Yang MK, Su RC. Oczyszczanie, charakterystyka i klonowanie genów depolimerazy polihydroksymaślanowej Aspergillus fumigatus stosowanej do degradacji polihydroksymaślanu, bursztynianu polietylenu i bursztynianu polibutylenu. Pchnięcie Poly Degrad. 2018;154:186–94.
-
Seo H, Kim S, Son HF, Sagong HY, Joo S, Kim KJ. Wytwarzanie pozakomórkowej PETazy z Ideonella sakaiensis przy użyciu peptydów sygnałowych zależnych od sek w E. coli. Biochem Biophys Res Commun. 2019;508(1):250–5.
-
Perz V, Bleymaier K, Sinkel C, Kueper U, Bonnekessel M, Ribitsch D i in. Specyficzność substratowa kutynaz na poliestrach alifatyczno-aromatycznych i na ich modelowych podłożach. Nowa biotechnologia. 2016;33(2):295–304.
-
Acero EH, Ribitsch D, Steinkellner G, Gruber K, Greimel K, Eiteljoerg I, et al. Enzymatyczna hydroliza powierzchniowa PET: wpływ zróżnicowania strukturalnego na właściwości kinetyczne kutynaz z Thermobifida. makrocząsteczki. 2011;44(12):4632–40.
-
Sulaiman S, Yamato S, Kanaya E, Kim JJ, Koga Y, Takano K i in. Izolacja nowego homologu kutynazy o aktywności degradującej politereftalan etylenu z kompostu z gałęzi liściastych za pomocą podejścia metagenomicznego. Appl Environ Microbiol. 2012;78(5):1556.
-
Kawai F, Kawabata T, Oda M. Aktualna wiedza na temat enzymatycznej degradacji PET i jej możliwości zastosowania w gospodarce odpadami i innych dziedzinach. Appl Microbiol Biotechnol. 2019;103(11):4253–68.
-
Ronkvist ÅM, Xie W, Lu W, Gross RA. Katalizowana kutynazą hydroliza poli(tereftalanu etylenu). makrocząsteczki. 2009;42(14):5128–38.
-
Marten E, Müller RJ, Deckwer WD. Badania hydrolizy enzymatycznej poliestrów I. modelowe estry niskocząsteczkowe i poliestry alifatyczne. Pchnięcie Poly Degrad. 2003;80(3):485–501.
-
Marten E, Müller RJ, Deckwer WD. Badania enzymatycznej hydrolizy poliestrów. II. Kopoliestry alifatyczno-aromatyczne. Pchnięcie Poly Degrad. 2005;88(3):371–81.
-
Müller RJ, Schrader H, Profe J, Dresler K, Deckwer WD. Enzymatyczna degradacja poli(tereftalanu etylenu): szybka hydroliza przy użyciu hydrolazy z T. fusca. Macromol Rapid Comm. 2005;26(17):1400–5.
-
Tournier V, Topham CM, Gilles A, David B, Folgoas C, Moya-Leclair E i in. Zaprojektowana depolimeraza PET do rozkładania i recyklingu plastikowych butelek. Natura. 2020;580(7802):216–9.
-
Che S, Men Y. Syntetyczne konsorcja mikrobiologiczne do biosyntezy i biodegradacji: obietnice i wyzwania. J Indust Microbiol Biotechnol. 2019;46(9-10):1343–58.
-
Zanaroli G, Di Toro S, Todaro D, Varese GC, Bertolotto A, Fava F. Charakterystyka dwóch konsorcjów drobnoustrojów degradujących olej napędowy wzbogaconych z nieaklimatyzowanego, złożonego źródła mikroorganizmów. Fabryki komórek mikrobów. 2010;9(1):10.
-
McCarty NS, Ledesma-Amaro R. Narzędzia biologii syntetycznej do inżynierii społeczności drobnoustrojów na potrzeby botechnologii. Trendy Biotechnologia. 2019;37(2):181–97.
-
Bernstein HC, Carlson RP. Inżynieria konsorcjów mikrobiologicznych dla fabryk komórkowych: systemy in vitro do systemów in silico. Comput Struct Biotechnol J. 2012;3:e201210017.
Tworzywa sztuczne i mikrobiom: skutki i rozwiązania
Przez:
Mikrobiom środowiskowy tom 16 , Numer artykułu: 2 ( 2021 )
Deklaracje etyczne
Zgoda etyczna i zgoda na udział
Nie były wymagane żadne aprobaty ani zgody etyczne.
Konkurujące interesy
Nie deklaruje się żadnych konkurencyjnych interesów.
Finansowanie
Ta praca została przeprowadzona w ramach projektu Aotearoa Impacts and Mitigation of Microplastics (AIM 2 ), w ramach którego otrzymano fundusze z grantu Endeavour Fund (C03X1802) nowozelandzkiego Ministerstwa Biznesu, Innowacji i Zatrudnienia (MBIE). Dodatkowe wsparcie zapewniono również w ramach stypendium doktoranckiego Uniwersytetu w Auckland (dla SM) oraz funduszy stypendialnych dla doktorantów przekazanych przez George Mason Centre for the Natural Environment (dla VG).
Dodatkowe informacje
Uwaga wydawcy
Springer Nature pozostaje neutralny w odniesieniu do roszczeń jurysdykcyjnych na opublikowanych mapach i przynależności instytucjonalnej.
Link do artykułu: https://environmentalmicrobiome.biomedcentral.com/articles/10.1186/s40793-020-00371-w
Prawa i uprawnienia
Otwarty dostęp Ten artykuł jest objęty licencją Creative Commons Attribution 4.0 International License, która zezwala na używanie, dzielenie się, adaptację, dystrybucję i powielanie na dowolnym nośniku lub w dowolnym formacie, pod warunkiem, że podasz odpowiednie oznaczenie oryginalnego autora (autorów) i źródła, podać link do licencji Creative Commons i wskażesz, czy dokonano zmian. Obrazy lub inne materiały osób trzecich zawarte w tym artykule są objęte licencją Creative Commons, chyba że zaznaczono inaczej w informacji o autorze materiału. Jeśli materiał nie jest objęty licencją Creative Commons, a zamierzone użycie jest niezgodne z przepisami prawa lub wykracza poza dozwolone użycie, musisz uzyskać pozwolenie bezpośrednio od właściciela praw autorskich. Aby zobaczyć kopię tej licencji, odwiedźhttp://creativecommons.org/licenses/by/4.0/. Zrzeczenie się licencji Creative Commons Public Domain Dedication ( http://creativecommons.org/publicdomain/zero/1.0/ ) ma zastosowanie do danych udostępnionych w tym artykule, o ile nie określono inaczej w linii kredytowej do danych.
Obraz wyróżniający: Pozostałości pisklęcia albatrosa, który był karmiony przez rodziców wyłowionymi odpadami plastikowymi co doprowadziło do jego śmierci. Autorstwa Duncan Wright – USFWS, Domena publiczna, https://commons.wikimedia.org/w/index.php?curid=4129070